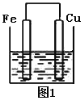
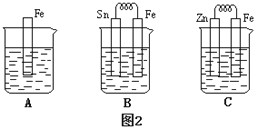
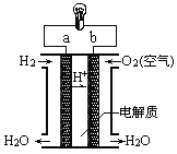
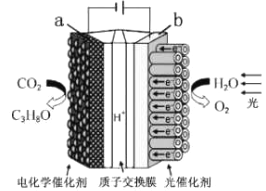
题目内容
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如下:
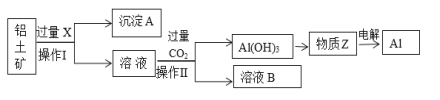
(1)操作Ⅱ的名称___________,用到的玻璃仪器有_______________。
(2)X是___________,操作Ⅱ通入过量CO2的离子方程式:____________。
(3)沉淀A的主要成分是________,溶液B中的成分为:_______________
【答案】过滤 烧杯、玻璃棒、漏斗 NaOH溶液 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- Fe2O3 NaHCO3
【解析】
Al2O3、Fe2O3和硫酸反应,要将氧化铝和Fe2O3分离出来,应该选择氢氧化钠,将Al2O3溶解为可溶性的NaAlO2,则固体难溶物是Fe2O3,即试剂X为氢氧化钠,沉淀中含有Fe2O3,向NaAlO2中通足量CO2来获得Al(OH)3沉淀,发生AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,Al(OH)3加热分解生成Al2O3,电解熔融的Al2O3可得Al,以此解答该题。
(1)向铝土矿中加入NaOH溶液,Al2O3与NaOH溶液发生反应生成可溶性的NaAlO2和水,而Fe2O3不能反应,过滤,得到的沉淀A是Fe2O3,溶液中含有NaAlO2。过滤使用的玻璃仪器有烧杯、漏斗、玻璃棒;
(2)根据(1)可知溶液X是NaOH溶液;由于酸性H2CO3>Al(OH)3,向NaAlO2溶液中通入过量CO2气体,发生反应:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,然后过滤,得到Al(OH)3沉淀,滤液B中含有NaHCO3;所以操作Ⅱ是过滤;
(3)根据上述分析可知沉淀A是Fe2O3,溶液B中的成分为NaHCO3。

 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124形式存在于溶液中。“废渣2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124![]() R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1)
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1)
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,达到平衡时n(CO2)=0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.若温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应