题目内容
【题目】下表是元素周期表的一部分,按要求完成各小题。
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)元素①的元素符号:_______________
(2)元素⑧的单质电子式_______________
(3)元素⑤的原子结构示意图______________
(4)化学性质最不活泼的元素______(填元素符号,下同),非金属性最强的元素是________。金属性最强的单质_______。
(5)①③⑤三种元素的最高价氧化物水化物中,碱性最强的 _____(填化学式,下同)。①③⑤三种元素的原子半径由大到小的顺序为_____________。
(6)某元素的最高价氧物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素的最高价氧化物和盐酸反应的化学方程式为 _____,与氢氧化钠溶液反应的化学方程式_____。
【答案】Na ![]()
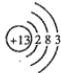 Ar F K NaOH r(Na)> r(Mg)> r(Al) Al2O3+6HCl=2AlCl3+3H2O Al2O3+2NaOH=2NaAlO2+H2O
Ar F K NaOH r(Na)> r(Mg)> r(Al) Al2O3+6HCl=2AlCl3+3H2O Al2O3+2NaOH=2NaAlO2+H2O
【解析】
根据元素在周期表中的位置知,①~11种元素分别是Na、K、Mg、Ca、Al、C、O、Cl、Br、Ar、F元素。
(1)根据元素在周期表中的位置知①的元素符号是Na,故答案为:Na;
(2)氯气分子中,2个氯原子通过共用一对电子,形成共价键,电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
(3)Al的原子序数为13,原子核外有3个电子层,最外层电子数为3,则原子结构示意图为 ,故答案为:
,故答案为: ;
;
(4)这些元素中,Ar元素化学性质最不活泼,在这些元素中,非金属性最强的元素在周期表右上角,非金属性最强的元素是F,金属性最强的元素在周期表左下角,金属性最强的元素是K,故答案为:Ar;F;K;
(5)同一周期元素,从左到右,元素的金属性逐渐减弱,元素的金属性越强,其最高价氧化物是水化物碱性越强,①③⑤三种元素的最高价氧化物水化物中,碱性最强的是NaOH,同一周期元素,原子半径随着原子序数增大而减小,①③⑤三种元素的原子半径由大到小的顺序为r(Na)> r(Mg)> r(Al),故答案为:NaOH;r(Na)> r(Mg)> r(Al);
(6)元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,为Al元素,该元素的最高价氧化物为Al2O3,它和盐酸反应的学方程式为:Al2O3+6HCl=2AlCl3+3H2O,与氢氧化钠溶液反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O,故答案为:Al2O3+6HCl=2AlCl3+3H2O;Al2O3+2NaOH=2NaAlO2+H2O 。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案