题目内容
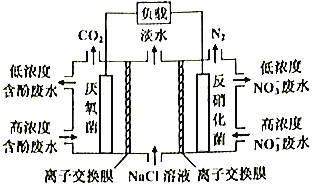
【题目】高炉煤气是炼铁厂排放的尾气,含有H2、N2、CO、CO2及O2,其中N2约为55%、CO约为25%、CO2约为15%、O2约为1.64%(均为体积分数)。某科研小组对尾气的应用展开研究:
(1)直接作燃料
已知:C(s)+O2(g)![]() CO2 (g) ΔH=-393.5kJ/mol
CO2 (g) ΔH=-393.5kJ/mol
2C(s)+O2(g)![]() 2CO (g) ΔH=-221kJ/mol
2CO (g) ΔH=-221kJ/mol
CO燃烧热的热化学方程式为__________。
(2)生产合成氨的原料
高炉煤气经过下列步骤可转化为合成氨的原料气:
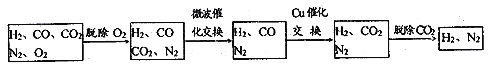
在脱氧过程中仅吸收了O2,交换过程中发生的反应如下,这两个反应均为吸热反应:
CO2+CH4![]() CO+H2(未配平) CO+H2O
CO+H2(未配平) CO+H2O![]() CO2+ H2
CO2+ H2
①气体通过微波催化交换炉需要较高温度,试根据该反应特征,解释采用较高温度的原因____________________________________________。
②通过铜催化交换炉后,所得气体中V(H2):V(N2)=__________。
(3)合成氨后的气体应用研究
①氨气可用于生产硝酸,该过程中会产生大气污染物NOx。为了研究对NOx的治理,该科研小组在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,发生如下反应:2NO(g)+Cl2(g)![]() 2ClNO(g) ΔH<0。10min时反应达平衡,测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡后n(Cl2)=__________mol。设此时NO的转化率为α1,若其它条件不变,上述反应在恒压条件下进行,平衡时NO的转化率为α2,则α1__________α2 (填“>”、“<”或“=”);平衡常数K__________(填增大”“减小 ”或“不变”)
2ClNO(g) ΔH<0。10min时反应达平衡,测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡后n(Cl2)=__________mol。设此时NO的转化率为α1,若其它条件不变,上述反应在恒压条件下进行,平衡时NO的转化率为α2,则α1__________α2 (填“>”、“<”或“=”);平衡常数K__________(填增大”“减小 ”或“不变”)
②氨气还可用于制备NCl3,NCl3发生水解产物之一具有强氧化性,该水解产物能将稀盐酸中的NaClO2氧化成ClO2,该反应的离子方程式为__________。
【答案】CO(g)+1/2O2(g)=CO2(g) ΔH=—283kJ/mol 该反应是吸热且熵增的反应,只有在较高温度下ΔG=ΔH-TΔS 才有可能小于0,反应才有利于自发进行 88.36:55(或1.61:1或8:5) 0.025 < 不变 HClO+2ClO2-+H+=2ClO2+Cl-+H2O
【解析】
(1)①C(s)+O2(g)=CO2 (g) ΔH=-393.5kJ/mol ②2C(s)+O2(g)![]() 2CO (g) ΔH=-221kJ/mol根据盖斯定律,将(①×2-②)÷2,整理可得:CO(g)+1/2O2(g)=CO2(g) ΔH=—283kJ/mol;
2CO (g) ΔH=-221kJ/mol根据盖斯定律,将(①×2-②)÷2,整理可得:CO(g)+1/2O2(g)=CO2(g) ΔH=—283kJ/mol;
(2)①该反应是吸热反应,且属于熵增的反应,只有在较高温度下△G=△H-T△S才有可能小于0,反应才有利于自发进行,因此气体通过微波催化交换炉需要较高温度;
②含有H2、N2、CO、CO2及O2,其中N2约为55%、CO约为25%、CO2约为15%、O2约为1.64%,则H2约为1-55%-25%-15%-1.64%=3.36%,假设气体总量为100mol,经过脱氧后含有55mol N2,25molCO、15molCO2、3.36molH2,经过CO2+CH4 ![]() 2CO+2H2,反应后气体中含有55mol N2,(25+15×2)molCO、(15×2+3.36)molH2,再经过CO+H2O
2CO+2H2,反应后气体中含有55mol N2,(25+15×2)molCO、(15×2+3.36)molH2,再经过CO+H2O![]() CO2+H2反应后,气体中含有55mol N2,(25+15×2)molCO2、(25+15×2+15×2+3.36)molH2,因此V(H2):V(N2)=n(H2):n(N2)=(25+15×2+15×2+3.36)mol:55mol=88.36:55=8:5;
CO2+H2反应后,气体中含有55mol N2,(25+15×2)molCO2、(25+15×2+15×2+3.36)molH2,因此V(H2):V(N2)=n(H2):n(N2)=(25+15×2+15×2+3.36)mol:55mol=88.36:55=8:5;
(3)①10min内v(ClNO)=7.5×10-3mol/(Lmin),则平衡是c(ClNO)=7.5×10-3mol/(Lmin)×10min=0.075 mol/L,n(ClNO)=0.075 mol/L×2L=0.15mol,根据2NO(g)+Cl2(g)![]() 2ClNO(g),反应的氯气为0.075mol,则平衡后n(Cl2)=0.1mol-0.075mol=0.025mol,由于该反应为气体体积减小的反应,若反应在恒压条件下进行,相当于平衡时增大压强,平衡正向移动,NO的转化率增大,即α1<α2;温度不变,平衡常数K不变;
2ClNO(g),反应的氯气为0.075mol,则平衡后n(Cl2)=0.1mol-0.075mol=0.025mol,由于该反应为气体体积减小的反应,若反应在恒压条件下进行,相当于平衡时增大压强,平衡正向移动,NO的转化率增大,即α1<α2;温度不变,平衡常数K不变;
②NCl3中Cl元素为+1价,NCl3发生水解产物之一具有强氧化性,为次氯酸,次氯酸能将稀盐酸中的NaClO2氧化成ClO2,反应的离子方程式为:HC1O+2C1O2-+H+=2ClO2↑+Cl-+H2O。

【题目】下表是元素周期表的一部分,表中序号分别代表某一元素。请回答下列问题.
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)可作半导体材料的元素是 ______(填元素符号);气态氢化物与其最高价氧化物的水化物可直接化合生成一种盐的元素是 _____(填名称);
(2)第三周期中离子半径最小的是___________(填离子符号);
(3)① ~ ⑨的最高价氧化物的水化物中:酸性最强的是 __________(填化学式);碱性最强的是________(填化学式),它与⑥的最高价氧化物的水化物反应的离子方程式为__________。
(4)⑧、⑨可形成A2B2型的化合物,分子中二者均满足8电子稳定结构,则其电子式为_________________。
【题目】下表是元素周期表的一部分,按要求完成各小题。
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)元素①的元素符号:_______________
(2)元素⑧的单质电子式_______________
(3)元素⑤的原子结构示意图______________
(4)化学性质最不活泼的元素______(填元素符号,下同),非金属性最强的元素是________。金属性最强的单质_______。
(5)①③⑤三种元素的最高价氧化物水化物中,碱性最强的 _____(填化学式,下同)。①③⑤三种元素的原子半径由大到小的顺序为_____________。
(6)某元素的最高价氧物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素的最高价氧化物和盐酸反应的化学方程式为 _____,与氢氧化钠溶液反应的化学方程式_____。