题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 0.2 mol·L-1的NaCl液中含Na+的数目为0.2NA
B. 标准状况下,11.2L水中含有的水分子数目为0.5NA
C. S2和S8的混合物共6.4g,所含硫原子数一定为0.2NA
D. 将100mL0.1mol·L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶体粒子的数目为0.01NA
【答案】C
【解析】
A.溶液体积未知,无法计算钠离子数目,故A错误;
B.水为液体,不可以利用气体摩尔体积进行计算,故B错误;
C.S2和S8的混合物共6.4g,所含硫原子数为![]() ×NA=0.2NA,故C正确;
×NA=0.2NA,故C正确;
D.一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故将100 mL 0.1 molL-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目小于0.01NA,故D错误;
正确答案:C。

【题目】下表是元素周期表的一部分,按要求完成各小题。
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)元素①的元素符号:_______________
(2)元素⑧的单质电子式_______________
(3)元素⑤的原子结构示意图______________
(4)化学性质最不活泼的元素______(填元素符号,下同),非金属性最强的元素是________。金属性最强的单质_______。
(5)①③⑤三种元素的最高价氧化物水化物中,碱性最强的 _____(填化学式,下同)。①③⑤三种元素的原子半径由大到小的顺序为_____________。
(6)某元素的最高价氧物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素的最高价氧化物和盐酸反应的化学方程式为 _____,与氢氧化钠溶液反应的化学方程式_____。
【题目】“变废为宝”是化工的重要主题。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有CuCl2,FeCl2等)制备碱式碳酸铜Cu2(OH)2CO3],其制备过程如下图所示:
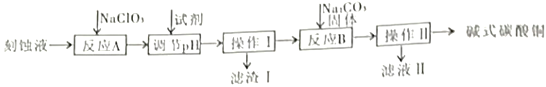
查阅资料得知,一定浓度的Cu2+、Fe2+、Fe3+生成氢氧化物沉淀的pH如下表:
金属离子 | Cu2+ | Fe2+ | Fe3+ |
开始沉淀的pH | 4.2 | 6.5 | 1.4 |
沉淀完全的pH | 6.7 | 9.7 | 3.7 |
(1)电子工业中用FeCl3溶液制作铜制印刷电路板,该反应的离子方程式为___________。
(2)操作I、操作Ⅱ所用的玻璃仪器除烧杯外还需要______________________。
(3)氯酸钠的作用是____________________________________________;反应A中氧化剂与还原剂物质的量之比是___________。
(4)调节pH的范围为___________,可以选择的试剂是___________(填序号)。
A.氨水 B.硫酸铜 C.氧化铜 D.氢氧化铜
(5)已知滤液Ⅱ中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:___________。
(6)若废液中CuCl2的含量为13.5%,则1吨废液理论上可提炼碱式碳酸铜________吨。