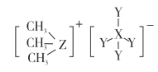题目内容
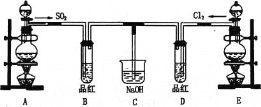
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图所示的实验装置测定Na2O2试样的纯度。(可供选用的试剂只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)回答下列问题:
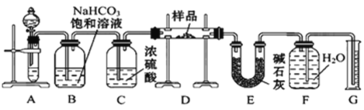
(1)装置B的作用是___________________; 装置E中碱石灰的作用是_________________________________。
(2)装置D中发生反应的化学方程式是_________________;______________________.
(3)超氧化钾(KO2)与过氧化钠一样能吸收CO2生成碳酸盐及O2,写出该反应的化学方程式_________________________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为___________。
【答案】除去气体中的HCl 吸收装置D中反应剩余的CO2 2Na2O2+2CO2=2Na2CO3+O2 Na2O+CO2 =Na2CO3 4KO2 +2CO2=2K2CO3+3O2 78%
【解析】
(1)获得的二氧化碳气体中含有氯化氢气体,可以用饱和碳酸氢钠来除去,浓硫酸具有吸水性,碱石灰可以吸收二氧化碳;
(2)根据氧化钠和过氧化钠的性质来回答;
(3)根据信息写出化学方程式;
(4)根据氧气的量和过氧化钠量的关系来获得过氧化钠质量,进而计算过氧化钠的纯度.
(1)碳酸钙和盐酸反应生成的二氧化碳气体中含有氯化氢气体,可以用饱和碳酸氢钠来除去,浓硫酸具有吸水性,可以将二氧化碳干燥,装置E中碱石灰的作用是吸收二氧化碳,防止对氧气的体积测量造成干扰,
故答案为:除去气体中的HCl;吸收装置D中反应剩余的二氧化碳;
(2)氧化钠和过氧化钠和二氧化碳反应的原理方程式分别为:2Na2O2+2CO2=2Na2CO3+O2 ; Na2O+CO2 =Na2CO3 ,
故答案为:2Na2O2+2CO2=2Na2CO3+O2 ; Na2O+CO2 =Na2CO3 ;
(3)超氧化钾(KO2)与过氧化钠一样能吸收CO2生成碳酸盐及O2,依据元素守恒可知碳酸盐应该是碳酸钾,反应的化学方程式是:4KO2 +2CO2=2K2CO3+3O2 ,
故答案为:4KO2 +2CO2=2K2CO3+3O2;
(4)根据反应2Na2O2+2CO2=2Na2CO3+O2 反应结束后测得气体体积为224mL(标准状况),即生成的氧气的量0.01mol,过氧化钠的物质的量为0.02mol,
过氧化钠的纯度=0.02mol×78g/mo÷l2.0g×100%=78%,
故答案为:78%.

 快乐5加2金卷系列答案
快乐5加2金卷系列答案【题目】“结晶玫瑰”具有强烈的玫瑰香气,属于结晶型固体香料,在香料和日用化工产品中具有广阔的应用价值。“结晶玫瑰”的化学名称为乙酸三氯甲基苯甲酯,通常用三氯甲基苯基甲醇和醋酸酐为原料制备。
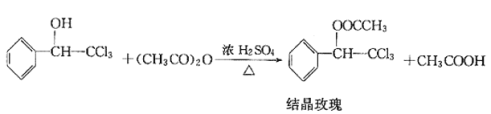
已知:
物质 | 在乙醇中的溶解性 | 在水中的溶解性 | 熔点℃ |
三氯甲基苯基甲醇 | 溶 | 不溶 | — |
醋酸酐 | 溶 | 溶 | -73 |
结晶玫瑰 | 溶 | 不溶 | 88 |
醋酸 | 易溶 | 易溶 | 16.6 |
部分实验装置以及操作步骤如下:
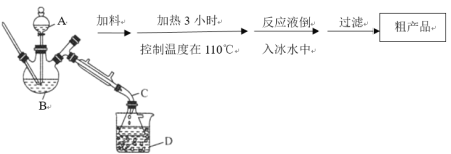
请根据以上信息,回答下列问题:
(1)装置中仪器B的名称是___________。
(2)加料时,应先加入三氯甲基苯基甲醇和醋酸酐,然后慢慢加入浓硫酸并搅拌。待混合均匀后,最适宜的加热方式为油浴加热,用油浴加热的理由是_______________。有同学认为装置中A仪器也可改为另一种漏斗,该漏斗的名称是___________,它的作用是____________。
现有同学设计如下方案把粗产品进行提纯。
(3)①将粗产品溶解在________(填“水”、“乙醇”或“粗产品滤液”)中均匀混合,用水浴加热到70℃,回流溶剂使粗产品充分溶解,得到无色溶液。然后将所得溶液经过__________(填操作方法)析出白色晶体,整个过程中不需要用到的仪器是_______(选择相应字母填空)。
A.冷凝管 B.烧杯 C.蒸发皿 D.玻璃棒
②将步骤①所得混合物过滤、洗涤、干燥得到白色晶体,请列举一种常见的实验室干燥的方法_______。可通过测定晶体的熔点判断所得晶体是否是结晶玫瑰,具体做法为:加热使其熔化测其熔点,实验现象为__________。
(4)ag的三氯甲基苯基甲醇与足量乙酸酐充分反应得到结晶玫瑰bg,则产率是_________。(用含a、b的式子表示)