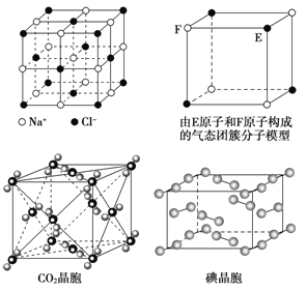
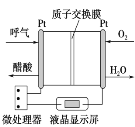
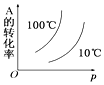
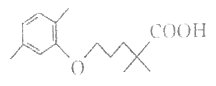��Ŀ����
����Ŀ����ѧ�Һϳɳ���һ�����ڷ�����ϵ�����Ļ����� A������ͼ��ʾ����������Ԫ�� X��Y��Zԭ���������������� �� Zλ�ڵ������ڡ�Z�� Y2�����γɷ��� ZY6���÷��ӳ�������ѹ�����豸�ľ�Ե���ʡ����й��� X��Y��Z����������ȷ����
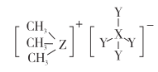
A.���Ӱ뾶��Y ��Z
B.�⻯����ȶ��ԣ�X ��Y
C.����������Ӧˮ��������ԣ�X ��Z
D.������ A�У�X��Y��Z����㶼�ﵽ 8�����ȶ��ṹ
���𰸡�D
��������
������Ԫ�� X��Y��Zԭ�������������۲������ӽṹ ��Zʧȥһ�����Ӻ��Գ�3�����ۼ���˵��Zԭ��������Ϊ6�����ӣ�����Zλ�ڵ������ڣ�����ZΪSԪ�أ������ӽṹΪ
��Zʧȥһ�����Ӻ��Գ�3�����ۼ���˵��Zԭ��������Ϊ6�����ӣ�����Zλ�ڵ������ڣ�����ZΪSԪ�أ������ӽṹΪ ��Y��һ�����ۼ���Ϊ-1�ۣ����ǵ�������Ԫ�أ���ԭ����������X��ӦΪFԪ�أ���Ȼ����H����Ϊ�������Ѿ���H����X�õ�һ�����ӳ�4�����ۼ���˵���������Ϊ3�����ӣ�ΪBԪ�أ��ݴ˷������
��Y��һ�����ۼ���Ϊ-1�ۣ����ǵ�������Ԫ�أ���ԭ����������X��ӦΪFԪ�أ���Ȼ����H����Ϊ�������Ѿ���H����X�õ�һ�����ӳ�4�����ۼ���˵���������Ϊ3�����ӣ�ΪBԪ�أ��ݴ˷������
A�����Ӳ���F-<S2-�����Ӱ뾶F-<S2- ������Z> Y��Aѡ�����
B���ǽ�����Խǿ�����⻯��Խ�ȶ����ǽ����ԣ�F>B������BH3<HF������ X < Y��Bѡ�����
C���ǽ�����Խǿ������������Ӧˮ���������Խǿ���ǽ����ԣ�S>B��������H3BO3�����ᣩ<H2SO4��ǿ�ᣩ������X < Z��Cѡ�����
D����������������֪��������A��X��Y��Z����㶼�ﵽ8�����ȶ��ṹ��Dѡ����ȷ��
��ѡD��

 С��ſ�ʱ��ҵϵ�д�
С��ſ�ʱ��ҵϵ�д� һ������ϵ�д�
һ������ϵ�д� �Ƹ�С״Ԫ���ֳ������ϵ�д�
�Ƹ�С״Ԫ���ֳ������ϵ�д� �¸��̵�ѧϵ�д�
�¸��̵�ѧϵ�д� ����ͬѧһ����ʦȫ�źþ�ϵ�д�
����ͬѧһ����ʦȫ�źþ�ϵ�д�