题目内容
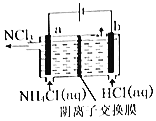
【题目】碱式硫酸铁[Fe(OH)SO4]是重要的化工原料,工业上利用废铁屑(含少量氧化铝、 氧化铁等)生产碱式硫酸铁的工艺流程如下:
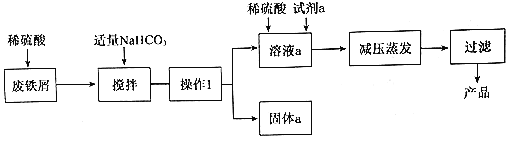
已知:Ksp[Fe(OH)3]=2.6×10-39 Ksp[Fe(OH)2]=4.9×10-17 Ksp[Al(OH)3]=8×10-32(单位略)
(1)工业生产中,常将废铁块处理为废铁屑,其目的是_______;用稀硫酸处理废铁屑的过程中______个氧化还原反应发生。
(2)加入碳酸氢钠后,发生反应的主要离子方程式为_______。
(3)若要使沉淀完全(一般认为离子浓度小于10-5 molL-1即为沉淀完全),溶液的pH为________;此溶液中亚铁离子的物质的量浓度不高于_____molL-1才不会生成沉淀。
(4)从环保、产品纯度角度分析.试剂a最好选择下列物质中的_____(填字母代号)。
A NaClO B KNO3 C H2O2 D KMnO4
(5)若搅拌过程中NaHCO3过量,会产生FeCO3沉淀和大量气泡,若将NaHCO3改为 Na2CO3过量时产生的沉淀为FeCO3和Fe(OH)2的混合物,试解释混合物中有Fe(OH)2的原因___。
【答案】增大表面积,加快反应速率 2 Al3++3HCO3-=Al(OH)3↓+3CO2↑ 5.3 12.25 C 改为Na2CO3以后,由于Na2CO3溶液的碱性(或水解程度)比NaHCO3溶液的强,所以会生成Fe(OH)2
【解析】
废铁屑中含少量氧化铝、氧化铁等,将过量废铁屑加入稀硫酸中,发生反应 Fe+H2SO4=FeSO4+H2↑、Al2O3+3H2SO4=Al2(SO4)3+3H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe2(SO4)3+Fe=3FeSO4,反应后加入NaHCO3并搅拌,调节溶液的pH,发生反应Al3++3HCO3-=Al(OH)3↓+3CO2↑,所以固体a成分是Al(OH)3,过滤得到硫酸亚铁,向硫酸亚铁溶液中加入稀硫酸和氧化剂,酸性条件下,发生氧化还原反应生成铁离子,将溶液蒸发浓缩、过滤得到碱式硫酸铁,以此解答该题。
(1)将废铁块处理为废铁屑,固体表面积增大,可加快反应速率,涉及反应为Fe+H2SO4=FeSO4+H2↑、Al2O3+3H2SO4=Al2(SO4)3+3H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe2(SO4)3+Fe=3FeSO4,有2个属于氧化还原反应,即Fe+H2SO4=FeSO4+H2↑、Fe2(SO4)3+Fe=3FeSO4;
(2)反应后加入NaHCO3并搅拌,调节溶液的pH,碳酸氢根和铝离子双水解,发生反应Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)若要使A13+沉淀完全,Ksp[Al(OH)3]=c(Al3+)·c3(OH-)=8×10-32,当c(Al3+)=10-5 molL-1时c(OH-)=![]() mol/L=2×10-9mol/L,c(H+)=5×10-6mol/L,pH=5.3;根据Ksp[Fe(OH)2]= c(Fe2+)·c2(OH-)=4.9×10-17可知,此溶液中亚铁离子的物质的量浓度不高于
mol/L=2×10-9mol/L,c(H+)=5×10-6mol/L,pH=5.3;根据Ksp[Fe(OH)2]= c(Fe2+)·c2(OH-)=4.9×10-17可知,此溶液中亚铁离子的物质的量浓度不高于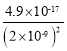 =12.25mol/L;
=12.25mol/L;
(4)从环保、产品纯度角度分析,试剂a最好选择过氧化氢即C选项,可避免生成杂质或污染性气体;
(5)由于碳酸钠水解程度比碳酸氢钠大,溶液碱性较强,因此会生成Fe(OH)2。

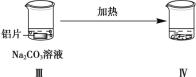
【题目】探究铝片与Na2CO3溶液的反应:
| | |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为 H2和CO2) |
下列说法正确的是( )
A.Na2CO3溶液中存在水解平衡:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B.推测出现白色浑浊的原因:AlO2-+HCO3-+H2O=Al(OH)3↓+CO2↑
C.对比Ⅰ、Ⅲ,说明 Na2CO3溶液能破坏铝表面的保护膜
D.加热和H2逸出对CO32-水解平衡移动方向的影响是相反的