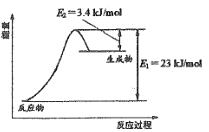
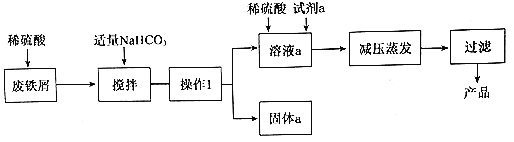
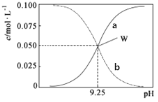
题目内容
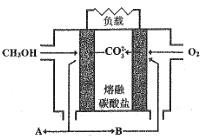
【题目】NCl3是一种黄色粘稠状液体,常用干杀菌消毒,工业上通过情性电极电解氯化铵和盐酸的方法制备NCl3,其原理如图所示。下列说法正确的是
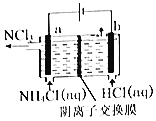
A.在b极区产生的气体是H2
B.a极的电极反应式为NH4+-6e-+ 4OH-+3Cl-=NCl3+4H2O
C.溶液中的Cl-移向a极区
D.若将阴离子交换膜改为阳离子交换膜,NH4Cl的利用率不变
【答案】AC
【解析】
根据图示信息知道:a电极是阳极,该电极上发生失电子的氧化反应,反应式为:NH4++3Cl--6e-=NCl3+4H+,b电极是阴极,氢离子得电子的还原反应,电极反应式为:2H++2e-=H2↑,电解过程中,阴离子可以经过阴离子交换膜移向阳极,则Cl-移向a极区。
A. b电极是阴极,氢离子得电子的还原反应,电极反应式为:2H++2e-=H2↑,所以在b极区产生的气体是H2,故A正确;
B. a电极是阳极,该电极上发生失电子的氧化反应,反应式为:NH4++3Cl--6e-=NCl3+4H+,故B错误;
C. 溶液中的Cl-移向阳极a极区,故C正确;
D. 若将阴离子交换膜改为阳离子交换膜,又a电极反应式为:NH4++3Cl--6e-=NCl3+4H+,则生成的氢离子经过阳离子交换膜移向阴极,而氯离子无法通过交换膜进入阳极区,导致产率降低,NH4Cl的利用率降低,故D错误。
故选:AC。

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案
相关题目