题目内容
【题目】水合肼(N2H4·H2O)可用作抗氧剂等,工业上常用尿素[CO(NH2)2]和 NaClO溶液反应制备水合肼。
已知:Ⅰ.N2H4·H2O 的结构如图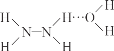 (…表示氢键)。
(…表示氢键)。
Ⅱ.N2H4·H2O 沸点 118 ℃,具有强还原性。
(1)将 Cl2 通入过量 NaOH 溶液中制备 NaClO,得到溶液 X,离子方程式是__。
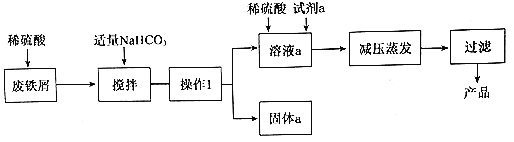
(2)制备水合肼:将溶液 X 滴入尿素水溶液中,控制一定温度,装置如图 a(夹持及控温装置已略)。充分反应后,A 中的溶液经蒸馏获得水合肼粗品后,剩余溶液再进一步处理还可获得副产品 NaCl 和Na2CO3·10H2O。

①A 中反应的化学方程式是__。
②冷凝管的作用是__。
③若滴加 NaClO 溶液的速度较快时,水合肼的产率会下降,原因是__。
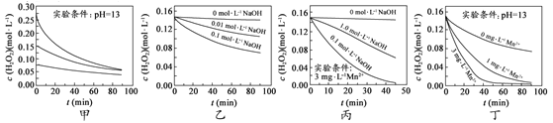
④NaCl 和 Na2CO3 的溶解度曲线如图 b。由蒸馏后的剩余溶液获得 NaCl 粗品的操作是__。
(3)水合肼在溶液中可发生类似 NH3·H2O 的电离,呈弱碱性;其分子中与 N 原子相连的 H 原子易发生取代反应。
①水合肼和盐酸按物质的量之比 1∶1 反应的离子方程式是__。
②碳酰肼(CH6N4O)是目前去除锅炉水中氧气的最先进材料,由水合肼与 DEC( ![]() )发生取代反应制得。碳酰肼的结构简式是__。
)发生取代反应制得。碳酰肼的结构简式是__。
【答案】Cl2 +2OH-=Cl-+ ClO-+H2O NaClO+CO(NH2)2+2NaOH ![]() N2H4·H2O+ NaCl+Na2CO3 冷凝回流水合肼 N2H4·H2O被NaClO氧化 加热至有大量固体析出,趁热过滤 N2H4·H2O+ H+=N2H5++H2O
N2H4·H2O+ NaCl+Na2CO3 冷凝回流水合肼 N2H4·H2O被NaClO氧化 加热至有大量固体析出,趁热过滤 N2H4·H2O+ H+=N2H5++H2O ![]()
【解析】
(1)Cl2与过量 NaOH溶液反应生成NaClO、NaCl和H2O,则得到溶液X的离子方程式为Cl2 +2OH-=Cl-+ ClO-+H2O;
(2)①A 中的反应为碱性条件下,次氯酸钠与尿素发生氧化还原反应生成水合肼、碳酸钠和氯化钠,反应的化学方程式NaClO+CO(NH2)2+2NaOH ![]() N2H4·H2O+ NaCl+Na2CO3;
N2H4·H2O+ NaCl+Na2CO3;
②由题意可知水合肼的沸点低,易挥发,为防止水合肼挥发,造成产率降低,应选用冷凝管冷凝回流,故答案为:冷凝回流水合肼;
③水合肼有强还原性,NaClO具有强氧化性,若滴加 NaClO 溶液的速度较快时,反应生成的水合肼会被次氯酸钠氧化,导致产率会下降,故答案为:N2H4·H2O被NaClO氧化;
④由溶解度曲线可知,碳酸钠的溶解度随温度变化大,氯化钠溶解度随温度变化小,则获得 NaCl 粗品的操作是加热至有大量固体析出,趁热过滤,防止降温时碳酸钠析出,故答案为:加热至有大量固体析出,趁热过滤;
(3)①水合肼和盐酸按物质的量之比 1∶1反应生成N2H5Cl和水,反应的离子方程式N2H4·H2O+ H+=N2H5++H2O;
②一定条件下,水合肼与![]() 发生取代反应生成
发生取代反应生成![]() 和乙醇,则碳酰肼的结构简式是
和乙醇,则碳酰肼的结构简式是![]() ,故答案为:
,故答案为:![]() 。
。