题目内容
16.在室温条件下,向含有H2SO4的CuSO4溶液中逐滴加入含a mol溶质的NaOH溶液,恰好使溶液的pH=7,下列叙述正确的是( )| A. | 溶液中2c(Na+)=c(SO42-) | B. | 0<沉淀的物质的量<$\frac{a}{2}$ mol | ||
| C. | 沉淀的物质的量$\frac{a}{2}$ mol | D. | 原溶液中c(H2SO4)=$\frac{a}{2}$ mol•L-1 |
分析 A.根据电荷守恒判断;
B.氢氧化钠先和硫酸中和,若氢氧化钠全部和硫酸铜反应时得到沉淀的物质的量为$\frac{a}{2}$mol;
C.采用极限法确定沉淀的物质的量;
D.c(H2SO4)=$\frac{a}{2}$mol/L,消耗氢氧化钠a mol,硫酸铜没有反应,硫酸铜水解显酸性.
解答 解:A.溶液的pH=7,溶液中存在的电解质是硫酸钠,c(H+)=c(OH-),溶液中存在电荷守恒:c(Na+)+c(H+)=2c(SO42-)+c(OH-),所以c(Na+)=2c(SO42-),故A错误;
B.氢氧化钠全部和硫酸铜反应时得到沉淀的物质的量为$\frac{a}{2}$mol,但是氢氧化钠会先和硫酸反应,故沉淀的量小于$\frac{a}{2}$mol,故B正确;
C.氢氧化钠全部和硫酸铜反应时得到沉淀的物质的量为$\frac{a}{2}$mol,但是氢氧化钠会先和硫酸反应,故沉淀的量小于$\frac{a}{2}$mol,故C错误;
D.当c(H2SO4)=$\frac{a}{2}$mol/L时,会消耗氢氧化钠a mol,硫酸铜没有参与反应,溶液的组成为硫酸钠和硫酸铜,而硫酸铜水解显酸性,不会使溶液的pH=7,故D错误.
故选B.
点评 本题主要考查了溶液混合后所发生的反应、盐的水解以及溶液中的电荷守恒等知识,难度较大,利用极限法来分析解答即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.用下列装置制取并收集NO2气体,其中最合理的是( )
| A. | 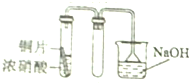 | B. | 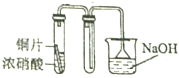 | ||
| C. |  | D. | 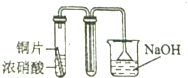 |
4.常温下,下列关系正确的是( )
| A. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| D. | 向硝酸银溶液中逐滴滴加物质的量浓度相等的氯化钾和铬酸钾的混合溶液,若先产生白色的氯化银沉淀,则有:Ksp(AgCl)<Ksp(Ag2CrO4) |
11.下列说法正确的是( )
| A. | 按系统命名法, 的名称为2,7,7-三甲基-3-乙基辛烷 的名称为2,7,7-三甲基-3-乙基辛烷 | |
| B. | 实验证实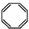 可使Br2/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 可使Br2/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 | |
| C. | DDT的结构简式为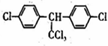 ,分子中最多有14个碳原子共平面 ,分子中最多有14个碳原子共平面 | |
| D. |  的单体是CH3-C≡C-CH3和CH2=CH-CN 的单体是CH3-C≡C-CH3和CH2=CH-CN |
1.设NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 46 g C2H6O中含有的C-H键数一定为5NA | |
| B. | 常温常压下,17 g甲基(-14CH3)所含电子总数为9NA | |
| C. | 标准状况下,11.2 L CO2和乙炔的混合气体所含π键数目为NA | |
| D. | CO2气体与足量的Na2O2反应,固体增重28 g时转移了NA个电子 |
8.在构成原子的各种微粒中,决定元素种类的是( )
| A. | 质子数 | B. | 中子数 | C. | 核外电子数 | D. | 质子数和中子数 |
5.下列属于吸热反应的是( )
| A. | 金属钠与水的反应 | B. | 氢气在氯气中燃烧 | ||
| C. | 浓硫酸的稀释 | D. | Ba(OH)2•8H2O和NH4Cl(固体)混合 |
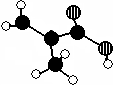 化工厂生产的某产品只含C、H、O三种元素,分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).
化工厂生产的某产品只含C、H、O三种元素,分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).