题目内容
15.在某温度下,取X和Y各1摩尔放入2L密闭容器中发生如下反应:X+2Y?2Z.反应达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2.则Y的转化率为多少?计算该温度下此反应的平衡常数?分析 在某温度下,取X和Y各1摩尔放入2L密闭容器中发生如下反应,利用三段式表示出平衡时各各组分的物质的量,根据到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2列方程计算n的值,再根据转化率=$\frac{消耗量}{起始量}$×100%,平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$.
解答 解:在某温度下,取X和Y各1摩尔放入2L密闭容器中发生如下反应,设反应的Y物质的量为n,则:
X(g)+2Y(g)?2Z(g)
起始量(mol):1 1 0
变化量(mol):0.5n n n
平衡量(mol):1-0.5n 1-n n
平衡后,测得混合气体中反应物的总物质的量与成物的总物质的量之比为3:2,则
(1-0.5n+1-n):n=3:2
解得n=$\frac{2}{3}$
则Y的转化率=$\frac{\frac{2}{3}mol}{1mol}$×100%=66.7%,
达到平衡状态各物质的平衡浓度为c(X)=$\frac{1mol-0.5×\frac{2}{3}mol}{2L}$=$\frac{1}{3}$
c(Y)=$\frac{1mol-\frac{2}{3}mol}{2L}$=$\frac{1}{6}$mol/L
c(Z)=$\frac{\frac{2}{3}mol}{2L}$=$\frac{1}{3}$mol/L
平衡常数K=$\frac{(\frac{1}{3})^{2}}{\frac{1}{3}×(\frac{1}{6})^{2}}$=12,
答:Y的转化率为67.7%,该温度下此反应的平衡常数为12.
点评 本题化学平衡的有关计算,难度不大,主要是转化率、平衡常数概念的计算应用,注意三段式解题法的利用,旨在考查学生对基础知识的理解掌握.

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案| A. | H+、NO3-、Fe2+、Cu2+ | B. | Ag+、NO3-、Cl-、K+ | ||
| C. | K+、Na +、HCO3-、SO42- | D. | Na+、NH4+、Br-、OH- |
| A. | 燃放焰火 | B. | 霓虹灯广告 | C. | 燃烧蜡烛 | D. | 平面镜成像 |
| A. | MnO2 | B. | WO3 | C. | Fe2O3 | D. | V2O5 |
| A. | 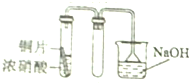 | B. | 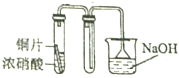 | ||
| C. |  | D. | 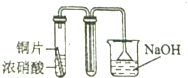 |
| A. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| D. | 向硝酸银溶液中逐滴滴加物质的量浓度相等的氯化钾和铬酸钾的混合溶液,若先产生白色的氯化银沉淀,则有:Ksp(AgCl)<Ksp(Ag2CrO4) |
| A. | 金属钠与水的反应 | B. | 氢气在氯气中燃烧 | ||
| C. | 浓硫酸的稀释 | D. | Ba(OH)2•8H2O和NH4Cl(固体)混合 |

