题目内容
【题目】(1)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。回答下列问题:
①NiO、FeO的晶体结构类型均与NaCl的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点:FeO____(填“<”或“>”)NiO。
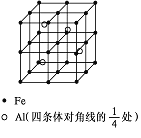
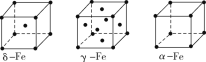
②铁有δ、γ、α三种同素异形体,各晶胞结构如图所示,则δ、α两种晶胞中铁原子的配位数之比为____。
(2)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数目之比为__;该晶体中,原子之间的相互作用是____。
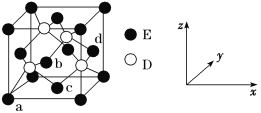
(3)某钙钛型复合氧化物如图所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。
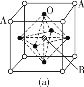
①用A、B、O表示这类特殊晶体的化学式:____。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价,导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为____。
③下列有关说法正确的是____。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧元素的第一电离能比氮元素的第一电离能大
C.锰的电负性为1.59,铬的电负性为1.66,说明锰的金属性比铬强
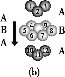
D.铬的堆积方式与钾相同,则其堆积方式如图(b)所示
【答案】(1)①< ② 4:3 (2) 3∶1 金属键 (3) ①ABO3② (1-x)∶x ③ AC
【解析】
试题(1)①NiO、FeO的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高。由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO。
②该晶胞中顶点上含有的原子数=![]() ×8=1,面心上含有的原子数=
×8=1,面心上含有的原子数=![]() ×6=3,所以一个晶胞中含有4个原子;δ、α两种晶胞中铁原子的配位数分别是8个和6个,所以δ、α两种晶胞中铁原子的配位数之比是4:3。
×6=3,所以一个晶胞中含有4个原子;δ、α两种晶胞中铁原子的配位数分别是8个和6个,所以δ、α两种晶胞中铁原子的配位数之比是4:3。
(2)元素金(Au)处于周期表中的第六周期,与Cu同族,则最外层电子数为1,则价电子排布式为5d106s1,在晶胞中Cu原子处于面心,N(Cu)=6×![]() =3,Au原子处于顶点位置,N(Au)=8×
=3,Au原子处于顶点位置,N(Au)=8×![]() =1,则该合金中Cu原子与Au原子数量之比为3:1,为金属晶体,原子间的作用力为金属键。
=1,则该合金中Cu原子与Au原子数量之比为3:1,为金属晶体,原子间的作用力为金属键。
(3)①由图1可知,晶胞中A位于顶点,晶胞中含有A为8×![]() =1个,B位于晶胞的体心,含有1个,O位于面心,晶胞中含有O的个数为6×
=1个,B位于晶胞的体心,含有1个,O位于面心,晶胞中含有O的个数为6×![]() =3,则化学式为ABO3。
=3,则化学式为ABO3。
②设La1-xAxMnO3中三价锰与四价锰的物质的量分别为m和n,则有3(1x)+2x+3m+4n=6、m+n=1,解之得m=1-x,n=x,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为(1-x)∶x。
③A、由金属在周期表中的位置可知镧、锰、氧分别位于周期表f、d、p区,故A正确;B、氮元素的2p轨道电子处于半充满状态,稳定性强,因此氮元素的第一电离能大于氧元素的第一电离能,故B错误;C、元素的电负性越强,金属性越弱,故C正确;D、图中堆积方式为镁型,故D错误,故答案为:A C。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案【题目】碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
(1)合成该物质的步骤如下:
步骤1:配制0.5mol·L-1 MgSO4溶液和0.5mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500mL NH4HCO3溶液于1000mL三颈烧瓶中,开启搅拌器。温度控制在50℃。
步骤3:将250mL MgSO4溶液逐滴加入NH4HCO3溶液中,1min内滴加完后,用氨水调节溶液pH到9.5。
步骤4:放置1h后,过滤,洗涤。
步骤5:在40℃的真空干燥箱中干燥10h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。
①步骤2控制温度在50℃,较好的加热方法是_________。
②步骤3生成MgCO3·nH2O沉淀的化学方程式为__________。
③步骤4检验沉淀是否洗涤干净的方法是__________。
(2)测定生成的MgCO3·nH2O中的n值。
称量1.000碳酸镁晶须,放入如图所示的广口瓶中加入适量水,并滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5h,反应后期将温度升到30℃,最后将烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。
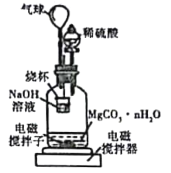
①图中气球的作用是_________。
②上述反应后期要升温到30℃,主要目的是______。
③测得每7.8000g碳酸镁晶须产生标准状况下CO2为1.12L,则n值为_______。
(3)碳酸镁晶须可由菱镁矿获得,为测定某菱镁矿(主要成分是碳酸镁,含少量碳酸亚铁、二氧化硅)中铁的含量,在实验室分别称取12.5g菱镁矿样品溶于过量的稀硫酸并完全转移到锥形瓶中,加入指示剂,用0.010mol/L H2O2溶液进行滴定。平行测定四组。消耗H2O2溶液的体积数据如表所示。
实验编号 | 1 | 2 | 3 | 4 |
消耗H2O2溶液体积/mL | 15.00 | 15.02 | 15.62 | 14.98 |
①H2O2溶液应装在_________(填“酸式”或“碱式”)滴定管中。
②根据表中数据,可计算出菱镁矿中铁元素的质量分数为_________ %(保留小数点后两位)。