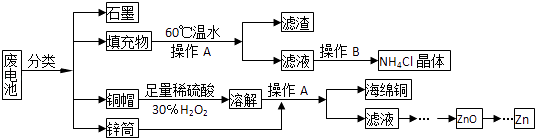
题目内容
【题目】NA代表阿伏加德罗常数的值,下列有关叙述不正确的是( )
A.在熔融状态下,1 mol Na2O2 完全电离出的离子数目为3 NA
B.将CO2通过Na2O2使固体质量增加mg,反应中转移的电子数 ![]()
C.在标准状况下,22.4LCH4与18 gH2O所含有的电子数均为10NA
D.含1mol Cl﹣的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH![]() 数为 NA
数为 NA
【答案】B
【解析】解:A、Na2O2 在熔融状态下电离出2个钠离子和1个过氧根,故1mol过氧化钠能电离出3mol离子即3NA个,故A正确;
B、将二氧化碳通过过氧化钠固体,固体增加的质量相当于对已CO的质量反应中转移电子数为 ![]() NA , 故B错误;
NA , 故B错误;
C、标况下,22.4L甲烷的物质的量是1mol,含有10mol电子,18g水物质的量是1mol,含有10mol电子,所含有的电子数均为10NA , 故C正确;
D、加入一定量的氨水后,溶液呈中性,n(H+)=n(OH﹣),据溶液中的电荷守恒:n(Cl﹣)+n(OH﹣)=n(NH![]() )+n(H+),所以n(Cl﹣)=n(NH
)+n(H+),所以n(Cl﹣)=n(NH![]() )=1mol,即铵根离子为NA个,故D正确.
)=1mol,即铵根离子为NA个,故D正确.
故选B.

练习册系列答案
相关题目
【题目】“创新”化学小组对某Na2CO3和NaHCO3的混合溶液(以下简称“样品溶液”)的组成进行探究,取20.0mL样品溶液,向其中逐滴滴入0.10molL﹣1的稀盐酸,边滴边振荡,滴入盐酸的体积和产生的现象见下表.
反应阶段 | Ⅰ | Ⅱ | Ⅲ |
盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
现象 | 无气体 | 产生气体 | 无气体 |
请回答下列问题:
(1)配制0.10molL﹣1的稀盐酸250mL,需要10.0molL﹣1的浓盐酸的体积为mL.
(2)计算样品溶液中碳酸根离子的物质的量浓度.