��Ŀ����
����Ŀ���ظ������׳ƺ췯��![]() ������Ҫ�Ļ�����Ʒ��ǿ����������ҵ�Ʊ��췯�Ƶ��������£�
������Ҫ�Ļ�����Ʒ��ǿ����������ҵ�Ʊ��췯�Ƶ��������£�
(1)��ѧ�Ͽɽ�ijЩ��д�����������ʽ����![]() ��д��
���![]() ����
����![]() ���______��
���______��
(2)���ո�����ʱ����ʯ�����ܵ�![]() ���ɿ�����ˮ��
���ɿ�����ˮ��![]() ����Ӧ��ѧ����ʽ���£�
����Ӧ��ѧ����ʽ���£�![]() Ϊ�˼ӿ�÷�Ӧ�ķ�Ӧ���ʣ��ɲ�ȡ�Ĵ�ʩ��______
Ϊ�˼ӿ�÷�Ӧ�ķ�Ӧ���ʣ��ɲ�ȡ�Ĵ�ʩ��______![]() дһ�ּ���
дһ�ּ���![]()
(3)��֪![]() �ڲ�ͬ��������Һ���в�ͬ�ķ�Ӧ���磺
�ڲ�ͬ��������Һ���в�ͬ�ķ�Ӧ���磺
![]() ��
��![]()
���������Һ���м����������������ԭ����______��
�ڻ����Һ�������ʵĻ�ѧʽ��______��
(4)�ں�![]() ��ˮ�д�����ƽ�⣺
��ˮ�д�����ƽ�⣺![]() ����д����ƽ���ƽ�ⳣ������ʽ
����д����ƽ���ƽ�ⳣ������ʽ![]() ______����������ˮϡ�ͣ�ƽ�⽫______�ƶ�
______����������ˮϡ�ͣ�ƽ�⽫______�ƶ�![]() ��������������������������
��������������������������![]() ��
��
(5)����ƽ������Һ��ԭ���з��������ӷ�Ӧ��
______![]() ___
___![]() ______
______![]() --______
--______![]() ______
______![]() ______
______![]() ��
��
���𰸡�![]() �����ʯ�������¶� �������ܳ���
�����ʯ�������¶� �������ܳ���![]() �����ʣ�����������
�����ʣ�����������![]() �ȸ�����
�ȸ����� ![]() ��
��![]()
![]() ���� 4 6 19 8 3 14
���� 4 6 19 8 3 14
��������
��������봿�ͨ��������գ�����ȡ��õ�Na2CrO4��Na2CO3�������������ᣬ�õ������Һ�Һ���Na2Cr2O7��Na2SO4��Ȼ��ᾧ�ɵõ�Na2Cr2O7���壬
��1�����Na2SiO3��д��Na2OSiO2���Fe��CrO2��2�����������ʽ��
��2������Ӱ�컯ѧ��Ӧ���ʵ����ط�����
��3���ٹ���ͼʾ��������Ϣ��֪���������ܳ���Na2CO3�����ʣ�����������Na2Cr3O10�ȸ����
�ڷ����˷�Ӧ2CrO42-+2H+=Cr2O72-+H2O��������Na2Cr2O7��Na2SO4��
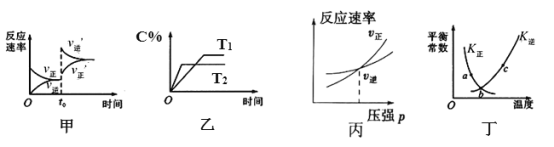
��4����ѧƽ�ⳣ������ָ��һ���¶��£����淴Ӧ�ﵽƽ��ʱ��������Ũ�ȵĻ�ѧ���������ݵij˻����Ը���Ӧ��Ũ�ȵĻ�ѧ���������ݵij˻����õı�ֵ��ˮ����Ҫд������ˮ�ٽ�ƽ�������ƶ���
��5��Cr2O72-��Cr3+��S2-��S2O32-�����ݵ���ת���غ���ƽ��
��������봿�ͨ��������գ�����ȡ��õ�Na2CrO4��Na2CO3�������������ᣬ�õ������Һ�Һ���Na2Cr2O7��Na2SO4��Ȼ��ᾧ�ɵõ�Na2Cr2O7���壬
(1)Fe(CrO2)2����Ԫ�ػ��ϼ���+2�ۣ�������ΪFeO����Ԫ�ػ��ϼ�+3�ۣ�������ΪCr2O3������Fe(CrO2)2д����������ʽΪFeOCr2O3���ʴ�Ϊ��FeOCr2O3��
(2)����Ӧ��Ӵ�������Լӿ췴Ӧ���ʣ������¶ȿ��Դ��ӿ췴Ӧ���ʣ��ʴ�Ϊ�������ʯ�������¶ȣ�
(3)�������������Գ���̼���ƣ������ᷢ����Ӧ3CrO42+4H+=Cr3O102+2H2O��������Na2Cr3O10�ȸ�������Ա�������������ᣬ�ʴ�Ϊ���������ܳ���![]() �����ʣ�����������
�����ʣ�����������![]() �ȸ����
�ȸ����
�����ڷ����˷�Ӧ2CrO42+2H+=Cr2O72+H2O��������![]() ��
��![]() �������������ʵĻ�ѧʽ
�������������ʵĻ�ѧʽ![]() ��
��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��![]() ��
��
(4)���ݻ�ѧƽ�ⳣ���Ķ��壬��֪Cr2O72(aq)+H2O(l)2CrO42(aq)+2H+(aq)��ƽ�ⳣ��K=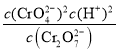 ����ˮϡ�ͣ��ٽ�ˮ�⣬ƽ�������ƶ����ʴ�Ϊ��
����ˮϡ�ͣ��ٽ�ˮ�⣬ƽ�������ƶ����ʴ�Ϊ��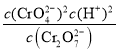 ������
������
(5) Cr2O72��Cr3+��1mol Cr2O72��õ������ʵ���Ϊ1mol��2��(63)=6mol��S2��S2O32��2molS2ʧȥ�������ʵ���Ϊ1mol��2��[2(2)]=8mol�����ݵ���ת���غ㣬��С������Ϊ24�����Է��������ӷ�ӦΪ��4Cr2O72+6S2+19H2O�T8Cr(OH)3��+3S2O32+14OH���ʴ�Ϊ��4��6��19��8��3��14��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����ͭ����һ����Ҫ��ͭ��ʯ����Ҫ��������ͭ��Cu2S��������Fe2O3��SiO2��һЩ���������ʡ�һ���Ի�ͭ��ʯΪԭ���Ʊ�����ͭ����Ĺ����������£�

��֪�����ֽ��������������������������pH��Χ���±���ʾ����ʼ������pH����������Ũ��Ϊ1.0mol/L���㣩
���� | ��ʼ������pH | ��ȫ������pH |
Fe3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
�ش���������
��1����ȡ��õ��Ľ���Һ�к���CuSO4��MnSO4��д����ȡʱ����CuSO4��MnSO4��Ӧ�Ļ�ѧ����ʽ__________��
��2������pH��Ŀ����___________��pH�ĵ��ڷ�ΧΪ___________��
��3������MnCO3���������ӷ���ʽΪ___________��
��4������AΪ___________��
��5���ɻ�ͭ����ȡͭ�ķ�Ӧ���̿��Ա�ʾΪ��
2Cu2S��s��+3O2��g���T 2Cu2O��s��+ 2SO2��g����H=��768.2kJ/mol
2Cu2O��s��+ Cu2S��s���T 6Cu��s��+ SO2��g����H=" +116.0" kJ/mol
����Cu2S��O2���ȷ�Ӧ����Cu���Ȼ�ѧ����ʽΪ___________��
��6�����ú�85% Cu2S��Mr=160���Ļ�ͭ�����Ʊ���ˮCu��NO3��2�������ȡ��Ϊ95%������pHʱ��Cu 3%��������������5%δת��ΪCuO����������������ģ���1.6 kg�����Ļ�ͭ��������Ʊ�__________mol��ˮCu��NO3��2��(��������ȷ��С�����1λ)