题目内容
【题目】常温下,Na2CO3和NaHCO3的混合溶液中c(![]() )、c(
)、c(![]() )与pH的关系如图所示[假设c(Na2CO3)+c(NaHCO3)=0.100 mol·L-1]。下列说法正确的是( )
)与pH的关系如图所示[假设c(Na2CO3)+c(NaHCO3)=0.100 mol·L-1]。下列说法正确的是( )

A.图中E点溶液表示浓度均为0.05 mol·L-1的Na2CO3和NaHCO3溶液混合后所得到的溶液
B.pH=10的溶液中:c(H+)+c(Na+)+c(H2CO3)=c(OH-)+c(![]() )
)
C.pH=11的溶液中:c(![]() )<c(
)<c(![]() )
)
D.向E点溶液中加入等体积0.100 mol·L-1的NaOH溶液,c(![]() )与c(
)与c(![]() )之和保持不变
)之和保持不变
【答案】C
【解析】
A. E点表示c(CO32-) = c(HCO3-),碳酸根的水解程度大于碳酸氢根,0.05 mol·L-1的Na2CO3和NaHCO3溶液混合后所得到的溶液不能使c(CO32-) = c(HCO3-),故A错误;
B. 根据物料守恒c(HCO3-)+c(CO32-)+c(H2CO3)=0.100mol/L和电荷守恒c(H+)+c(Na+)=c(OH-)+2c(CO32-)+ c(HCO3-)可知pH=10的溶液中:c(H+)+c(Na+)+c(H2CO3)=c(OH-)+c(CO32-)+0.100mol·L-1,故B错误;
C. 碳酸根的水解程度大于碳酸氢根,因此碳酸根的浓度越大,pH越大。二者浓度相等时,溶液的pH>10,因此pH=11的溶液中: c(Na2CO3) > c(NaHCO3), 故C正确;
D. 在E点溶液中加入等体积0.100mol·L-1的NaOH溶液碳酸氢钠转化为碳酸钠,根据物料守恒可知c(CO32-)与c(HCO3-)之和发生变化,故D错误;
正确答案是C。

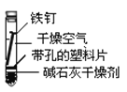
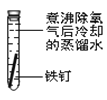
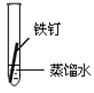
【题目】某课外小组同学对不同条件下铁钉的锈蚀进行了实验。
实验序号 | ① | ② | ③ | ④ |
实验 内容 |
|
|
|
|
一周后观察:
(1)铁钉被腐蚀程度最大的是___(填实验序号)。
(2)实验③中主要发生的是____(填“化学腐蚀”或“电化学腐蚀”)。
(3)烧过菜的铁锅未及时洗净(含氯化钠的残留液),第二天便出现红棕色锈斑,试写出有关的电极反应式: 负极____;
(4)根据上述实验,你认为铁发生电化学腐蚀的条件是____。
(5)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上。为防护金属被腐蚀可采取的措施有___(填序号)。
①健身器材刷油漆 ②自行车钢圈镀铬 ③将钢管用导线与镁条连接 ④将钢管用导线与碳棒连接