题目内容
在127℃和1.0×105Pa时,向某容器中放入18.4gN2O4使之发生反应N2O4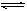 2NO2并达到平衡,此时测得容器内混合气体的密度比原来减少1/3(温度和压强不变)。计算:
2NO2并达到平衡,此时测得容器内混合气体的密度比原来减少1/3(温度和压强不变)。计算:
(1)N2O4的分解率;
(2)平衡混合物的平均分子量。
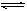 2NO2并达到平衡,此时测得容器内混合气体的密度比原来减少1/3(温度和压强不变)。计算:
2NO2并达到平衡,此时测得容器内混合气体的密度比原来减少1/3(温度和压强不变)。计算:(1)N2O4的分解率;
(2)平衡混合物的平均分子量。
(1)N2O4的分解率为50%;
(2)平衡时混合气体的平均分子量为61.33。
(2)平衡时混合气体的平均分子量为61.33。
依题意nN2O4=(18.4g)/92g/mol=0.2mol
平衡混合气密度比原来减少1/3
∴(n起始/n平衡)=(ρ平衡/ρ起始)
=(2/3/1)=(2/3)
则有:n平衡=(3/2)n起始=(3/2)×0.2mol=0.3mol
(1)设N4O4分解率为x,则有:
N2O4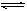 2NO2??Δn
2NO2??Δn
1??????2????1
0.2xmol?????(0.3mol-0.2mol)
解得?x=(0.1mol/0.2mol)=0.5=50%
(2)m总=18.4g
n总=0.3mol
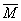 =(m总/n总)=(18.4/0.3)=61.33
=(m总/n总)=(18.4/0.3)=61.33
平衡混合气密度比原来减少1/3
∴(n起始/n平衡)=(ρ平衡/ρ起始)
=(2/3/1)=(2/3)
则有:n平衡=(3/2)n起始=(3/2)×0.2mol=0.3mol
(1)设N4O4分解率为x,则有:
N2O4
 2NO2??Δn
2NO2??Δn1??????2????1
0.2xmol?????(0.3mol-0.2mol)
解得?x=(0.1mol/0.2mol)=0.5=50%
(2)m总=18.4g
n总=0.3mol
 =(m总/n总)=(18.4/0.3)=61.33
=(m总/n总)=(18.4/0.3)=61.33
练习册系列答案
相关题目
 xC(g),2min时反应达到平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol/L。请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol/L。请填写下列空白: 2NH3(g)(正反应为放热反应)达到平衡后,只改变一个条件时建立的新平衡的过程。填写下列各空(均填写图序号):
2NH3(g)(正反应为放热反应)达到平衡后,只改变一个条件时建立的新平衡的过程。填写下列各空(均填写图序号):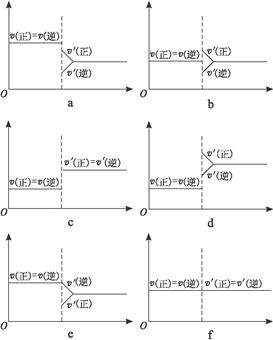
 PCl5(g)。达平衡后,PCl5为0.4mol。若此时再移走1mol PCl3和0.5mol Cl2,相同温度下重新达到平衡,PCl5的物质的量为( )
PCl5(g)。达平衡后,PCl5为0.4mol。若此时再移走1mol PCl3和0.5mol Cl2,相同温度下重新达到平衡,PCl5的物质的量为( ) N2O3+O2,N2O3又按N2O3
N2O3+O2,N2O3又按N2O3 2NH3(g);ΔH="-92.4" kJ·mol-1。请回答:
2NH3(g);ΔH="-92.4" kJ·mol-1。请回答: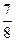 ,则N2的转化率a1= ,此时,反应放热 kJ;
,则N2的转化率a1= ,此时,反应放热 kJ; C(s)+4D(g);正反应放热图中a、b分别表示在一定条件下,D的体积分数〔φ(D)〕随反应时间t的变化情况。若使曲线b变为曲线a,可采取的措施是( )
C(s)+4D(g);正反应放热图中a、b分别表示在一定条件下,D的体积分数〔φ(D)〕随反应时间t的变化情况。若使曲线b变为曲线a,可采取的措施是( )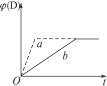
 2SO3,判断下列说法正确的是( )
2SO3,判断下列说法正确的是( )