题目内容
已知:N2(g)+3H2(g)
 2NH3(g);ΔH="-92.4" kJ·mol-1。请回答:
2NH3(g);ΔH="-92.4" kJ·mol-1。请回答:(1)合成氨工业中采取的下列措施可以用勒夏特列原理解释的是 (填字母)。
a.用铁触媒加快化学反应速率 b.采用较高压强(20MPa~50MPa)
c.将原料气中的少量CO等气体净化除去d.将生成的氨液化并及时从体系中分离出来
(2)一定温度下,在密闭容器中充入1 mol N2和3 mol H2并发生反应。若容器容积恒定,达到平衡时,气体的压强为原来的
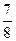 ,则N2的转化率a1= ,此时,反应放热 kJ;
,则N2的转化率a1= ,此时,反应放热 kJ;(1)bd(3分) (2)25%(3分) 23.1 kJ(3分)
(1)铁触媒是催化剂,不影响化学平衡, CO破坏催化剂,与平衡无关,故选bd
(2) N2(g ) + 3H2(g) 2NH3(g);
2NH3(g);
起始量 1 mol 3 mol 0 mol
变化量 amol 3amol 2amol
平衡量 (1-a)mol (3-3a)mol 2amol
由题意可得:(4-2a)/4=7/8,得a=0.25,
则N2的转化率a1=25%,反应放热为0.25×92.4="23.1" kJ
(2) N2(g ) + 3H2(g)
 2NH3(g);
2NH3(g);起始量 1 mol 3 mol 0 mol
变化量 amol 3amol 2amol
平衡量 (1-a)mol (3-3a)mol 2amol
由题意可得:(4-2a)/4=7/8,得a=0.25,
则N2的转化率a1=25%,反应放热为0.25×92.4="23.1" kJ

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 2Z(g)其中X2、Y2、Z的起始溶度分别为0.10 mol/L、0.30 mol/L、0.20 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
2Z(g)其中X2、Y2、Z的起始溶度分别为0.10 mol/L、0.30 mol/L、0.20 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
 2NO2并达到平衡,此时测得容器内混合气体的密度比原来减少1/3(温度和压强不变)。计算:
2NO2并达到平衡,此时测得容器内混合气体的密度比原来减少1/3(温度和压强不变)。计算: 2C(气)达平衡的标志是( )
2C(气)达平衡的标志是( )
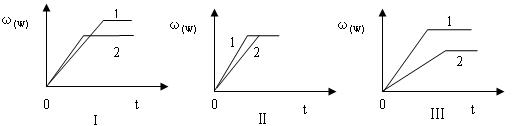
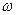 (W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是( )
(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是( )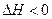
 2SO2(g)+O2(g),测得SO3的转化率为a%。其他条件不变,在上述平衡体系中再充入1 mol SO3气体,达到新的平衡时SO3的转化率为b%,则a、b的关系为( )
2SO2(g)+O2(g),测得SO3的转化率为a%。其他条件不变,在上述平衡体系中再充入1 mol SO3气体,达到新的平衡时SO3的转化率为b%,则a、b的关系为( ) 2SO3达平衡后,通18O2气体,再次达平衡时,18O存在于( )
2SO3达平衡后,通18O2气体,再次达平衡时,18O存在于( ) 2SO3的平衡体系中,增大O2的浓度,达新平衡后,下列说法不正确的是( )
2SO3的平衡体系中,增大O2的浓度,达新平衡后,下列说法不正确的是( )