��Ŀ����
��14�֣�T��ʱ����3mol����A��1mo1����Bͨ���ݻ�Ϊ2L�ҹ̶�������ܱ������У��������·�Ӧ��3A(g)+B(g) 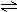 xC(g)��2minʱ��Ӧ�ﵽƽ��״̬���¶Ȳ��䣩����ʱ������ʣ����0.8molB�������C��Ũ��Ϊ0.4mol/L������д���пհף�
xC(g)��2minʱ��Ӧ�ﵽƽ��״̬���¶Ȳ��䣩����ʱ������ʣ����0.8molB�������C��Ũ��Ϊ0.4mol/L������д���пհף�
��1���ӷ�Ӧ��ʼ��ƽ��״̬������C��ƽ������Ϊ ��X= ��
��2������ԭƽ��������������ٳ���amolC����T��ﵽ�µ�ƽ�⣬��ʱB�����ʵ���Ϊn(B)= ��
��3�������¶Ⱥ��ݻ����䣬��ԭƽ�����������ߵ����ʵ��������µ�������ʹƽ��
�����ƶ����� ��
A.������ B.���ӱ� C.������0.4mol D.������0.4mol
��4�����������淴Ӧ���Ȼ�ѧ����ʽΪ:
3A(g)+B(g)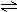 xC(g) ����H =��QKJ/mol (Q��0)
xC(g) ����H =��QKJ/mol (Q��0)
�������淴Ӧ�ﵽƽ���������ϵ�¶ȣ�����Ӧ���� �����������С�����䡱����ƽ�⽫ ������ơ��������ơ����ƶ�����
�������淴Ӧ�ﵽƽ�������ѹǿ������ϵ�¶Ƚ� ������ߡ��������͡����䡱��
�������淴Ӧ�ﵽƽ�����A�����H ����������С�����䡱
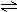 xC(g)��2minʱ��Ӧ�ﵽƽ��״̬���¶Ȳ��䣩����ʱ������ʣ����0.8molB�������C��Ũ��Ϊ0.4mol/L������д���пհף�
xC(g)��2minʱ��Ӧ�ﵽƽ��״̬���¶Ȳ��䣩����ʱ������ʣ����0.8molB�������C��Ũ��Ϊ0.4mol/L������д���пհף���1���ӷ�Ӧ��ʼ��ƽ��״̬������C��ƽ������Ϊ ��X= ��
��2������ԭƽ��������������ٳ���amolC����T��ﵽ�µ�ƽ�⣬��ʱB�����ʵ���Ϊn(B)= ��
��3�������¶Ⱥ��ݻ����䣬��ԭƽ�����������ߵ����ʵ��������µ�������ʹƽ��
�����ƶ����� ��
A.������ B.���ӱ� C.������0.4mol D.������0.4mol
��4�����������淴Ӧ���Ȼ�ѧ����ʽΪ:
3A(g)+B(g)
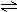 xC(g) ����H =��QKJ/mol (Q��0)
xC(g) ����H =��QKJ/mol (Q��0)�������淴Ӧ�ﵽƽ���������ϵ�¶ȣ�����Ӧ���� �����������С�����䡱����ƽ�⽫ ������ơ��������ơ����ƶ�����
�������淴Ӧ�ﵽƽ�������ѹǿ������ϵ�¶Ƚ� ������ߡ��������͡����䡱��
�������淴Ӧ�ﵽƽ�����A�����H ����������С�����䡱
��1��0.2mol��L-1 ��min��1��4��2����0.8 +0.2a��mol��3��D��4���ټӿ죻���Ƣڲ���۲���
��1��2min��ƽ��ʱ��������ʣ��0.8molB��������0.2molB��c(C)��0.4mol��L-1����n(C)��0.8mol��v(C)��0.4mol��L-1/2min��0.2mol��L-1 ��min��1�����ݷ�Ӧ��3A(g)+B(g) 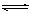 xC(g)��x��0.8mol/0.2mol��4��
xC(g)��x��0.8mol/0.2mol��4��
��2����ԭƽ��������������ٳ���amolC����T��ﵽ�µ�ƽ����ԭƽ���Ч����ʱB�ĺ���Ϊ20%������4xmol Cת��ΪB����ƽ��ʱn(B)��(0.8 + x)mol�����У�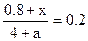 �����x��0.2a���ʴ�ƽ��ʱn(B)����0.8 +0.2a��mol��
�����x��0.2a���ʴ�ƽ��ʱn(B)����0.8 +0.2a��mol��
��3�����ڷ�Ӧǰ�����������ʵ������䣬ѡ��A��B���������൱�ڽ�ԭƽ����ʼ�����������ӱ������������䣬��ƽ��ʱ����ԭƽ���Ч��ѡ��C����������0.4mol��������ɣ��ȼ���0.4molC�����루1����ͬ��Ϊ��Чƽ�⣬�ټ���0.4molA��0.4molB����ʱʹ�÷�Ӧ��ϵ��n(A)�� n(B)< 3��1��������ɳ����ԭ������ѧƽ��Ҫ�������ƶ���ѡ��D��������С0.4mol��������ɣ��ȼ�С0.4molC�����루1����ͬ��Ϊ��Чƽ�⣬�ټ�С0.4molA��0.4molB����ʱʹ�÷�Ӧ��ϵ��n(A)�� n(B)> 3��1��������ɳ����ԭ������ѧƽ�������ƶ���
��4���������¶ȣ���Ӧ���ʼӿ죬ƽ���������ȷ�Ӧ�����ƶ������ƣ���
�����ڷ�Ӧǰ�����������ʵ������䣬����ѹǿƽ�ⲻ�ƶ���
�����ڡ� H��ʾ3molA(g)��1molB(g)��ȫ��Ӧ�ͷų������������Դ�ƽ����ټ���A���ԡ�H��Ӱ�죬��ֵҲ���䡣
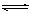 xC(g)��x��0.8mol/0.2mol��4��
xC(g)��x��0.8mol/0.2mol��4����2����ԭƽ��������������ٳ���amolC����T��ﵽ�µ�ƽ����ԭƽ���Ч����ʱB�ĺ���Ϊ20%������4xmol Cת��ΪB����ƽ��ʱn(B)��(0.8 + x)mol�����У�
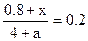 �����x��0.2a���ʴ�ƽ��ʱn(B)����0.8 +0.2a��mol��
�����x��0.2a���ʴ�ƽ��ʱn(B)����0.8 +0.2a��mol����3�����ڷ�Ӧǰ�����������ʵ������䣬ѡ��A��B���������൱�ڽ�ԭƽ����ʼ�����������ӱ������������䣬��ƽ��ʱ����ԭƽ���Ч��ѡ��C����������0.4mol��������ɣ��ȼ���0.4molC�����루1����ͬ��Ϊ��Чƽ�⣬�ټ���0.4molA��0.4molB����ʱʹ�÷�Ӧ��ϵ��n(A)�� n(B)< 3��1��������ɳ����ԭ������ѧƽ��Ҫ�������ƶ���ѡ��D��������С0.4mol��������ɣ��ȼ�С0.4molC�����루1����ͬ��Ϊ��Чƽ�⣬�ټ�С0.4molA��0.4molB����ʱʹ�÷�Ӧ��ϵ��n(A)�� n(B)> 3��1��������ɳ����ԭ������ѧƽ�������ƶ���
��4���������¶ȣ���Ӧ���ʼӿ죬ƽ���������ȷ�Ӧ�����ƶ������ƣ���
�����ڷ�Ӧǰ�����������ʵ������䣬����ѹǿƽ�ⲻ�ƶ���
�����ڡ� H��ʾ3molA(g)��1molB(g)��ȫ��Ӧ�ͷų������������Դ�ƽ����ټ���A���ԡ�H��Ӱ�죬��ֵҲ���䡣

��ϰ��ϵ�д�
�����Ŀ
 3C��g����2D��g����
3C��g����2D��g���� ��4min��������ڵķ�Ӧ�ﵽƽ�⣬A��Ũ��Ϊ2.4mol/L��B��Ũ��Ϊ1.8mol/L��t min���������ڵķ�Ӧ�ﵽƽ�⣬B��Ũ��Ϊ0.8mol/L�������������Ϣ�ش��������⣺
��4min��������ڵķ�Ӧ�ﵽƽ�⣬A��Ũ��Ϊ2.4mol/L��B��Ũ��Ϊ1.8mol/L��t min���������ڵķ�Ӧ�ﵽƽ�⣬B��Ũ��Ϊ0.8mol/L�������������Ϣ�ش��������⣺ 4C+6D���ﵽƽ��ʱ�����A��ת���ʴ���B��ת���ʡ���n��ȡֵ��Χ��ȷ����
4C+6D���ﵽƽ��ʱ�����A��ת���ʴ���B��ת���ʡ���n��ȡֵ��Χ��ȷ����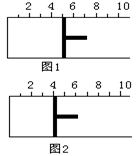

 2SO3����������H<0�����ﵽƽ��ı�һ��������x������������y��һ������ͼ�����ߵ��ǣ� �� ��
2SO3����������H<0�����ﵽƽ��ı�һ��������x������������y��һ������ͼ�����ߵ��ǣ� �� ��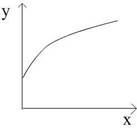
 2Z(g������X2��Y2��Z����ʼ�ܶȷֱ�Ϊ0.10 mol/L��0.30 mol/L��0.20 mol/L����һ�������£�����Ӧ�ﵽƽ��ʱ�������ʵ�Ũ���п�����( ��
2Z(g������X2��Y2��Z����ʼ�ܶȷֱ�Ϊ0.10 mol/L��0.30 mol/L��0.20 mol/L����һ�������£�����Ӧ�ﵽƽ��ʱ�������ʵ�Ũ���п�����( ��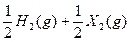

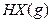 ��ƽ�ⳣ��Ϊ9������1.0 mol��HX(g)ͨ�����Ϊ1.0 L���ܱ������У��ڸ��¶�ʱHX(g)�����ֽ��ʽӽ���
��ƽ�ⳣ��Ϊ9������1.0 mol��HX(g)ͨ�����Ϊ1.0 L���ܱ������У��ڸ��¶�ʱHX(g)�����ֽ��ʽӽ���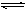 2�Σ������ﵽƽ�⣬��ʱ��������ڻ��������ܶȱ�ԭ������1��3���¶Ⱥ�ѹǿ���䣩�����㣺
2�Σ������ﵽƽ�⣬��ʱ��������ڻ��������ܶȱ�ԭ������1��3���¶Ⱥ�ѹǿ���䣩�����㣺 N2��3H2����ƽ��ʱ��N2�����ʵ�������Ϊa %��ά��������������¶����䣬�ֱ�ͨ�����м������ʣ��ﵽƽ��ʱ��������N2�����ʵ���������Ϊa %���ǣ���������
N2��3H2����ƽ��ʱ��N2�����ʵ�������Ϊa %��ά��������������¶����䣬�ֱ�ͨ�����м������ʣ��ﵽƽ��ʱ��������N2�����ʵ���������Ϊa %���ǣ���������