题目内容
【题目】向Fe2+、I-、Br-的溶液中通入适量Cl2,溶液中各种离子的物质的量变化如图所示。下列有关说法正确的是( )
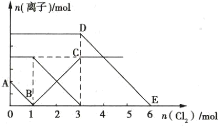
A.线段BC代表Cl-物质的量的变化情况
B.原混合溶液中c(FeBr2)=6mol·L-1
C.当通入2mol Cl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.原溶液中n(Fe2+):n(I-):n(Br-)=2:2:3
【答案】C
【解析】
还原性为I->Fe2+>Br-,则AB发生2I-+Cl2═I2+2Cl-,I-反应完毕再发生BC段:2Fe2++Cl2═2Fe3++2Cl-,最后发生DE段反应2Br-+Cl2═Br2+2Cl-。
A.B点时溶液中I-完全反应,溶液中存在Fe2+和Br-,BC段发生2Fe2++Cl2═2Fe3++2Cl-,代表Fe3+的物质的量的变化情况,故A错误;
B.由图可知,BC段发生2Fe2++Cl2═2Fe3++2Cl-,Fe2+反应完毕消耗氯气2mol,由方程式可知n(Fe2+)=2×2mol=4mol,则n(FeBr2)=4mol,缺少溶液的体积,故B错误;
C.AB段发生2I-+Cl2═I2+2Cl-,2mol的I-消耗1mol氯气,BC段发生2Fe2++Cl2═2Fe3++2Cl-,余下的1mol氯气再与2molFe2+反应,参加反应的n(Fe2+):n(I-)=1:1,通入2molCl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2═2Fe3++I2+4Cl-,故C正确;
D.由图可知AB段消耗氯气1mol,发生2I-+Cl2═I2+2Cl-,故n(I-)=2n(Cl2)=2mol,BC段发生2Fe2++Cl2═2Fe3++2Cl-,消耗氯气2mol,故n(Fe2+)=2n(Cl2)=2×2mol=4mol,DE段发生2Br-+Cl2═Br2+2Cl-,消耗氯气3mol,故n(Br-)=2n(Cl2)=6mol,故原溶液中n(Fe2+):n(I-):n(Br-)=4mol:2mol:6mol=2:1:3,故D错误;
故选C。