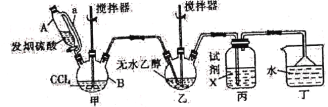
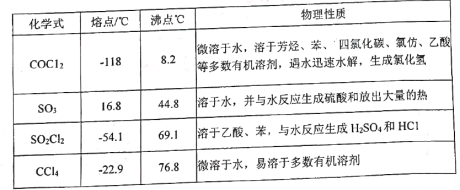
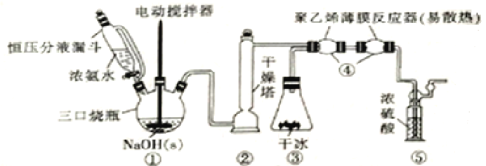
题目内容
【题目】在硫酸铜溶液中加入过量KCN,发生反应:CuSO4+4KCN=K2[Cu(CN)4]+K2SO4。
回答下列问题:
(1)基态铜原子的电子排布式为_____________。
(2)N、O、S元素分别与H形成的二元共价化合物中,既含有极性共价键,又含有非极性共价键的化合物是_____________(填化学式,写出两种)。
(3)N2O5晶体由两种离子构成,已知其阴离子(NO3-)的立体构型为平面三角形,则其阳离子(NO2+)的立体构型为_____________,阳离子中氮的杂化方式为_____________。
(4)相同条件下,SO2、CO2在水中的溶解度较大的是_______________(填分子式),理由是_________________________________________________________________。
(5)N、O元素第一电离能的大小关系为__________(用元素符号表示),原因为____________。
(6)铜晶体为面心立方最密堆积,配位数为_____________,铜的原子半径为127.8 pm,NA表示阿伏加德罗常数的值,列出铜晶体的密度计算式:_____________g·cm-3。
【答案】[Ar]3d104s1 H2O2、N2H4 直线形 sp杂化 SO2 CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在HO中的溶解度较大 N>O N元素2p3为半充满,较稳定,所以第一电离能更大 12 ![]()
【解析】
(1)Cu是29号元素,由于洪特规则,电子排布式为[Ar]3d104s1;
(2)N、O、S元素分别与H形成的二元共价化合物有:NH3、N2H4、H2O、H2O2、H2S,其中既含有极性共价键,又含有非极性共价键的化合物是H2O2(H-O-O-H)、N2H4(![]() );
);
(3)根据价层电子对互斥理论,可计算出NO2+的价层电子对数为2,故NO2+的空间构型为直线型,N的杂化方式为sp杂化;
(4)CO2空间构型为直线型,正负电荷中心重合,是非极性分子,SO2和H2O都是V型,是极性分子,根据“相似相溶”原理,极性分子易溶于极性溶剂,所以SO2在HO中的溶解度较大;
(5)N元素是第VA族,最外层的2p3为半充满,根据洪特规则,半满状态较稳定,所以第一电离能更大,故第一电离能N>O;
(6)铜晶体为面心立方最密堆积,最密堆积的配位数为12;面心立方最密堆积的晶胞中Cu原子在8个顶点和6个面心,每个晶胞中Cu的数目为![]() ,面心立方最密堆积中半径(r)和晶胞参数(a)的关系为
,面心立方最密堆积中半径(r)和晶胞参数(a)的关系为![]() ,晶胞密度
,晶胞密度![]()
![]() ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】甲醇是重要的化学工业基础原料和清洁液体燃料。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。
(2)反应③的ΔH_________0(填“>”或“<”)。
(3)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时υ正_____υ逆(填“>”、“=”或“<”)。
(4)500℃时2L密闭容器中投入a mol H2、b mol CO发生反应①;测得平衡时H2(g)、CO(g)的浓度(mol·L-1)分别为0.2、0.1则:
①平衡时H2的转化率为________(保留一位有效数字)。
②若向平衡后的容器中再投入a mol H2、b mol CO,达平衡后,CH3OH的体积分数与原平衡相比______________(填“增大”、“减小”或“不变”)