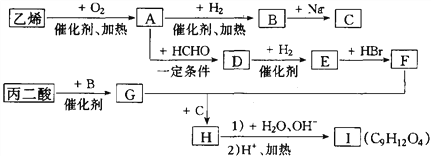
题目内容
【题目】(1)某有机化合物A 6.8g,完全燃烧后生成3.6g水和8.96LCO2 (标准状况),已知该有机物的蒸汽对氢气的相对密度为68,则该有机物的分子式为________________ 。
(2)该有机物A的核磁共振氢谱和红外光谱如下:
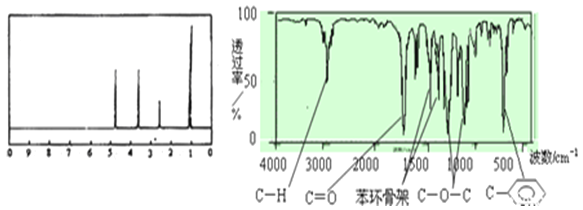
试推测有机物A的结构简式为____________________________ 。
(3)与A属于同类有机物的同分异构体共_____ 种,其结构简式分别为(不一定填满空格)
①________________ ② ③
④ ⑤ ⑥ ……
【答案】 C8H8O2  5 其它同分异构体(
5 其它同分异构体( 、
、![]() 、
、 、
、 、
、 )
)
【解析】(1). 有机化合物A对氢气的相对密度为68,则A的相对分子质量为68×2=136,有机物A的物质的量为n(A)=6.8g÷136g/mol=0.05mol,完全燃烧后生成水的物质的量为n(H2O)=3.6g÷18g/mol=0.2mol,氢原子的物质的量为n(H)=0.2mol×2=0.4mol,CO2的物质的量为n(CO2)=8.96L÷22.4L/mol=0.4mol,碳原子的物质的量为n(C)=0.4mol,则1个有机物A分子中含有8个碳原子、8个氢原子,O原子个数为: ![]() =2,所以该有机物的分子式为C8H8O2,故答案为:C8H8O2;
=2,所以该有机物的分子式为C8H8O2,故答案为:C8H8O2;
(2). 由核磁共振氢谱可知,有机物A中含有四种不同化学环境的氢原子,由红外光谱可知,有机物A中含有苯环且苯环上只有1个取代基,该取代基由甲基、酯基构成,再结合A的分子式C8H8O2,A的结构简式应为: ,故答案为:
,故答案为: ;
;
(3). 与A属于同类有机物的同分异构体有: 、
、![]() 、
、 、
、 、
、 共5种,故答案为:5;其它同分异构体(
共5种,故答案为:5;其它同分异构体( 、
、![]() 、
、 、
、 、
、 )。
)。

【题目】造成酸雨的主要物质是NO2和SO2,某科研小组进行如下研究。
(1)处理二氧化硫通常是先在水中把它氧化成硫酸,再用NH3·H2O吸收。
已知2NH3·H2O (aq) + H2SO4(aq)==(NH4)2SO4(aq)+ 2H2O(l) △H=-24.2kJ/mol,中和热△H=-57.3 kJ/mol则1mol NH3·H2O理论上完全电离时需要吸收的热量为________。
(2)常温下也可以用NaOH溶液直接吸收SO2,在吸收过程中,溶液pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 88:12 | 1:1 | 12:88 |
pH | 8.2 | 7.4 | 6.0 |
①当吸收液呈中性时,溶液中离子浓度由大到小排列顺序为___________。
②当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,在pH为4~7之间电解,硫元素在阴极上被还原为Na2S2O4,这是电化学脱硫技术之一。写出该阴极的电极反应式_______。
(3)向容积为2L,密闭容器中分别充入0.20molNO2和0.4mol SO2,发生SO2(g)+NO2(g) ![]() SO3(g)+NO(g) △H=-41.8 kJ/mol 在不同温度下测定同一时刻NO2的转化率,结果如下图所示。
SO3(g)+NO(g) △H=-41.8 kJ/mol 在不同温度下测定同一时刻NO2的转化率,结果如下图所示。

①a、c两点反应速率大小关系: v(a) ___v(c)。(填“>”、“<” 或“=”)
②温度为T2时从反应开始经过2min 达到b点,用SO3表示这段时间的反应速率为______,此温度下该反应的平衡常数为_______。若在此温度下,保持容器的容积不变,再向容器中充入0.10molNO2和0.2molSO2,NO2的转化率_______(填“增大”、“减小”或“不变”).
③NO2的转化率随温度升高先增大后减小的原因是____________。
【题目】已知CO是工业上重要的原料,可作燃料、冶炼金属、合成液体酒精等。
(1)研究表明:反应CO(g)+H2O(g) ![]() H2(g)+CO2(g) ⊿H = ?
H2(g)+CO2(g) ⊿H = ?
平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
Ⅰ.通过平衡常数随温度的变化情况,推断反应热⊿H________ 0 (填>、<、﹦ )
Ⅱ.若反应在500℃时进行,设起始的CO和H2O的浓度均为0.020 mol·L-1,在该条件下CO的平衡转化率为________。
(2)用CO做燃料电池电解CuSO4溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D 均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。

①甲中通入CO的电极为______(填“正”、“负”、“阴”、“阳”)极,该电极反应方程式为__________。
②若乙中A极析出的气体在标准状况下的体积为2.24L,此时要使乙中CuSO4溶液恢复到原来的浓度,需要加入的物质及其物质的量是(___________)。
A.0.1molCuO B.0.1molCu(OH)2 C.0.1molCu2(OH)2CO3
③丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示。完成丙装置C、D电极反应式:C:____________________________;D:________________________________;丙装置溶液中 c(Cl-)= _______________ mol/L 。