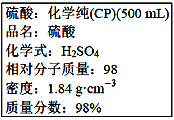
题目内容
【题目】常温下,下列溶液中的微粒浓度关系不正确的是
A. pH=8.3的某酸式盐NaHB的水溶液中:c (Na+) > c (HB-) > c (H2B) > c (B2-)
B. 等物质的量浓度的Na2S和NaHS溶液中:c (Na+)=2c (S2-) + c (HS-)
C. NH4HSO4溶液中滴加NaOH溶液至恰好呈中性:c (Na+) > c (SO42-) > c (NH4+) > c (OH-)=c (H+)
D. 0.1 mol / L NaH2PO4溶液中:c (Na+)=c (PO43-) + c (HPO42-) + c (H2PO4-) + c (H3PO4)
【答案】B
【解析】A,NaHB溶液的pH=8.3说明HB-的水解程度(HB-+H2O![]() H2B+OH-)大于HB-的电离程度(HB-
H2B+OH-)大于HB-的电离程度(HB-![]() H++B2-),溶液中粒子浓度由大到小的顺序为:c(Na+)
H++B2-),溶液中粒子浓度由大到小的顺序为:c(Na+)![]() c(HB-)
c(HB-)![]() c(H2B)
c(H2B)![]() c(B2-),A项正确;B,等物质的量浓度的Na2S和NaHS溶液中的电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),由于溶液呈碱性,c(OH-)
c(B2-),A项正确;B,等物质的量浓度的Na2S和NaHS溶液中的电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),由于溶液呈碱性,c(OH-)![]() c(H+),则c(Na+)
c(H+),则c(Na+)![]() c(HS-)+2c(S2-),B项错误;C,若NH4HSO4与NaOH以1:1物质的量之比混合,发生的反应为2NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+2H2O,所得溶液呈酸性,若NH4HSO4与NaOH以1:2物质的量之比混合,发生的反应为NH4HSO4+2NaOH=Na2SO4+NH3·H2O+H2O,所得溶液呈碱性,NH4HSO4溶液中滴加NaOH至溶液呈中性,则1:2
c(HS-)+2c(S2-),B项错误;C,若NH4HSO4与NaOH以1:1物质的量之比混合,发生的反应为2NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+2H2O,所得溶液呈酸性,若NH4HSO4与NaOH以1:2物质的量之比混合,发生的反应为NH4HSO4+2NaOH=Na2SO4+NH3·H2O+H2O,所得溶液呈碱性,NH4HSO4溶液中滴加NaOH至溶液呈中性,则1:2![]() n(NH4HSO4):n(NaOH)
n(NH4HSO4):n(NaOH)![]() 1:1,溶液由Na2SO4、(NH4)2SO4和NH3·H2O混合而成,溶液中的物料守恒为c(NH4+)+c(NH3·H2O)=c(SO42-),溶液中粒子浓度由大到小的顺序为:c(Na+)
1:1,溶液由Na2SO4、(NH4)2SO4和NH3·H2O混合而成,溶液中的物料守恒为c(NH4+)+c(NH3·H2O)=c(SO42-),溶液中粒子浓度由大到小的顺序为:c(Na+)![]() c(SO42-)
c(SO42-)![]() c(NH4+)
c(NH4+)![]() c(OH-)=c(H+),C项正确;D,H2PO4-在溶液中既存在电离平衡(H2PO4-
c(OH-)=c(H+),C项正确;D,H2PO4-在溶液中既存在电离平衡(H2PO4-![]() H++HPO42-、HPO42-
H++HPO42-、HPO42-![]() H++PO43-)又存在水解平衡(H2PO4-+H2O
H++PO43-)又存在水解平衡(H2PO4-+H2O![]() H3PO4+OH-),0.1mol/LNaH2PO4溶液中的物料守恒为:c(Na+)=c(H2PO4-)+c(HPO42-)+c(PO43-)+c(H3PO4),D项正确;答案选B。
H3PO4+OH-),0.1mol/LNaH2PO4溶液中的物料守恒为:c(Na+)=c(H2PO4-)+c(HPO42-)+c(PO43-)+c(H3PO4),D项正确;答案选B。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案