题目内容
【题目】造成酸雨的主要物质是NO2和SO2,某科研小组进行如下研究。
(1)处理二氧化硫通常是先在水中把它氧化成硫酸,再用NH3·H2O吸收。
已知2NH3·H2O (aq) + H2SO4(aq)==(NH4)2SO4(aq)+ 2H2O(l) △H=-24.2kJ/mol,中和热△H=-57.3 kJ/mol则1mol NH3·H2O理论上完全电离时需要吸收的热量为________。
(2)常温下也可以用NaOH溶液直接吸收SO2,在吸收过程中,溶液pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 88:12 | 1:1 | 12:88 |
pH | 8.2 | 7.4 | 6.0 |
①当吸收液呈中性时,溶液中离子浓度由大到小排列顺序为___________。
②当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,在pH为4~7之间电解,硫元素在阴极上被还原为Na2S2O4,这是电化学脱硫技术之一。写出该阴极的电极反应式_______。
(3)向容积为2L,密闭容器中分别充入0.20molNO2和0.4mol SO2,发生SO2(g)+NO2(g) ![]() SO3(g)+NO(g) △H=-41.8 kJ/mol 在不同温度下测定同一时刻NO2的转化率,结果如下图所示。
SO3(g)+NO(g) △H=-41.8 kJ/mol 在不同温度下测定同一时刻NO2的转化率,结果如下图所示。

①a、c两点反应速率大小关系: v(a) ___v(c)。(填“>”、“<” 或“=”)
②温度为T2时从反应开始经过2min 达到b点,用SO3表示这段时间的反应速率为______,此温度下该反应的平衡常数为_______。若在此温度下,保持容器的容积不变,再向容器中充入0.10molNO2和0.2molSO2,NO2的转化率_______(填“增大”、“减小”或“不变”).
③NO2的转化率随温度升高先增大后减小的原因是____________。
【答案】 45.2 kJ c(Na+)> c(HSO3-) > c(SO32-) > c(H+)= c(OH-) 2HSO3-+2H++2e-=S2O42-+2H2O < 0.04mol·L-1·min-1 8/3 不变 T2对应的b点为平衡点。T2前是平衡的建立过程,温度升高,反应速率加快,NO2转化率增大;T2后是平衡的移动过程,升高温度,平衡向吸热的逆反应方向移动,转化率减小
【解析】(1)由已知2NH3H2O(aq)+H2SO4(aq)=(NH4)2SO4(aq)+2H2O(l) △H=-24.2kJ/mol可得,①NH3H2O(aq)+H+=NH4+(aq)+H2O(l) △H=-12.1kJ/mol,②H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol,根据盖斯定律①-②可得:NH3H2O(aq)=NH4+(aq)+OH-(aq),△H=+45.2kJ/mol,则1mol NH3H2O理论上完全电离时需要吸收的热量为45.2kJ。
(2)①由表中数据可得,随着n(SO32-):n(HSO3-)值的减小,吸收液由碱性变化为酸性,且n(SO32-):n(HSO3-)=1:1时,溶液呈碱性,所以当吸收液呈中性时,n(SO32-)<n(HSO3-),又因为吸收液为Na2SO3和NaHSO3的混合溶液,弱离子的水解和电离都是微弱的,所以溶液中离子浓度由大到小排列顺序为:c(Na+)> c(HSO3-) > c(SO32-) > c(H+)= c(OH-)。②由题意,在pH为4~7之间电解NaHSO3溶液,硫元素在阴极上被还原为Na2S2O4,根据阴极得电子发生还原反应,且为酸性电解质溶液,所以电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O。
(3)①a、c两点都是在容积为2L,0.20molNO2和0.4molSO2发生同一反应时,同一时刻测定的数据,但a、c两点的温度不同,a点温度低于c点温度,所以a、c两点反应速率大小关系为:v(a)<v(c)。②温度为T2时从反应开始经过2min达到b点,NO2的转化率为80%,则反应的NO2为0.16mol,根据化学方程式可得,生成SO3(g)0.16mol,所以用SO3表示这段时间的反应速率为:0.16mol÷2L÷2min=0.04mol·L-1·min-1;由已知及前面的计算,列三段式:
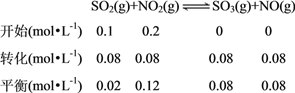 ,所以此温度下该反应的平衡常数为:K=
,所以此温度下该反应的平衡常数为:K=![]() =
=![]() =
=![]() 。该反应前后气体分子数不变,所以增大压强不影响化学平衡移动,若在此温度下,保持容器的容积不变,再向容器中充入0.10molNO2和0.2molSO2,达到的平衡与原平衡等效,所以NO2的转化率不变。③曲线表示在不同温度下测定同一时刻NO2的转化率,所以T2对应的b点为平衡点,T2之前是化学平衡建立过程,温度升高,反应速率加快,同一时刻测得的NO2转化率增大;T2之后是平衡的移动过程,升高温度,平衡向吸热方向移动,因为该反应逆反应吸热,所以温度升高,转化率减小。
。该反应前后气体分子数不变,所以增大压强不影响化学平衡移动,若在此温度下,保持容器的容积不变,再向容器中充入0.10molNO2和0.2molSO2,达到的平衡与原平衡等效,所以NO2的转化率不变。③曲线表示在不同温度下测定同一时刻NO2的转化率,所以T2对应的b点为平衡点,T2之前是化学平衡建立过程,温度升高,反应速率加快,同一时刻测得的NO2转化率增大;T2之后是平衡的移动过程,升高温度,平衡向吸热方向移动,因为该反应逆反应吸热,所以温度升高,转化率减小。

 名校课堂系列答案
名校课堂系列答案