��Ŀ����
����Ŀ���±���Ԫ�����ڱ���ǰ�����ڼ����еIJ���Ԫ�أ���ش��������

��1��a��f��gԪ������������ˮ���������ǿ������˳����____(�û�ѧʽ��ʾ)��
��2����Ԫ�ؿ�������Ԫ���γ�_____(��ѡ�����)�Ȼ�ѧ����
A.���Թ��ۼ� B.�Ǽ��Թ��ۼ� C.��� D.���Ӽ�
��3��d��f��h����Ԫ�ؿ��γ�һ����ǿ��ԭ�ԵĻ�����û������к��зǼ��Լ����仯ѧʽΪ_____����û������ˮ��Һ�м������ᷢ�������绯��Ӧ�����ӷ���ʽΪ______��
��4������������ij����Ԫ�ؿ��γ�һ�ֳ������л��ܼ�����������ȡ��ˮ�еĵⵥ�ʣ���ȡ���л������ɫΪ______����Һʱ�л���Ӧ��______(�����¿������������Ͽڵ�����)�����л��ܼ��ĵ���ʽ��______��
���𰸡�NaOH>LiOH>Al(OH)3 AD Na2S2O3 S2O32+2H+=S�� +SO2��+H2O ��ɫ �¿����� 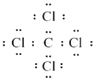
��������
����ͼʾԪ�����ڱ���֪��aΪLiԪ�أ�bΪB��cΪCԪ�أ�dΪOԪ�أ�eΪFԪ�أ�fΪNaԪ�أ�gΪAlԪ�أ�hΪSԪ�أ�iΪClԪ�أ��ݴ˽��Ԫ�������ɼ�Ԫ�ػ��������ʽ��
��1��������Խǿ������������ˮ�������Խǿ��������������ˮ���������ǿ������˳��ΪNaOH>LiOH>Al(OH)3��
��2��HԪ���������ǽ���Ԫ���γɵĻ�ѧ��Ϊ���Թ��ۼ���H��Na���γ����Ӽ�����AD��ȷ��
�ʴ�Ϊ��AD��
��3��O��Na��S����Ԫ�ؿ��γ�һ����ǿ��ԭ�ԵĻ�����û������к��зǼ��Լ����仯ѧʽΪNa2S2O3����û������ˮ��Һ�м�����������S���ʡ����������ˮ���÷�Ӧ�����ӷ���ʽΪ��S2O32+2H+=S�� +SO2��+H2O��
�ʴ�Ϊ��Na2S2O3��S2O32+2H+=S�� +SO2��+H2O��
��4������������ij����Ԫ�ؿ��γ�һ�ֳ������л��ܼ�����������ȡ��ˮ�еĵⵥ�ʣ����л��ܼ�Ϊ���Ȼ�̼�����Ȼ�̼���ܶȴ���ˮ������ȡ���л������ɫ��ɫ����Һʱ�л���Ӧ�ӷ�Һ©�����¿����������Ȼ�̼Ϊ���ۻ���������ʽΪ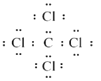 ��
��
�ʴ�Ϊ����ɫ���¿�������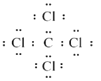 ��
��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ����a��b��c��d�ĸ������缫���йصķ�Ӧװ�ü����ַ�Ӧ�������£�
ʵ��װ�� |
|
|
|
|
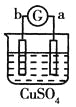
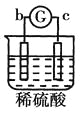
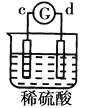
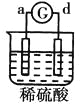
����ʵ������ | a��������Сb���������� | ��Һ�е�SO42-��b���ƶ� | d���ܽ�c����������� | ������a������d�� |
�ɴ˿��ж������ֽ����Ļ��˳����
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c