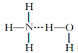题目内容
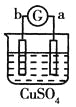
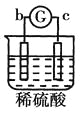
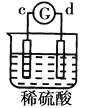
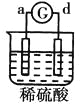
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小b极质量增加 | 溶液中的SO42-向b极移动 | d极溶解c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
【答案】C
【解析】
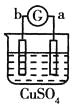 中a极质量减小b极质量增加,说明a是负极,b是正极,溶液中的铜离子在正极放电,则金属活动性a>b;
中a极质量减小b极质量增加,说明a是负极,b是正极,溶液中的铜离子在正极放电,则金属活动性a>b;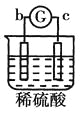 中溶液中的SO42-向b极移动,说明b电极是负极,则金属活动性b>c;
中溶液中的SO42-向b极移动,说明b电极是负极,则金属活动性b>c;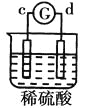 中d极溶解c极有气体产生,说明d电极是负极,c电极是正极,溶液中的氢离子放电,则金属活动性d>c;
中d极溶解c极有气体产生,说明d电极是负极,c电极是正极,溶液中的氢离子放电,则金属活动性d>c;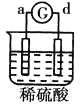 中电流从a极流向d极,说明a电极是正极,d电极是负极,则金属活动性d>a;则金属活动性d>a>b>c,答案选C。
中电流从a极流向d极,说明a电极是正极,d电极是负极,则金属活动性d>a;则金属活动性d>a>b>c,答案选C。
【点晴】
本题通过金属活动性强弱比较为载体,侧重考查了原电池的工作原理;该题的关键是明确原电池的工作原理、特别是正负极的判断依据,电极反应式的书写等。

 阅读快车系列答案
阅读快车系列答案【题目】类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是)
选项 | 已知 | 类推 |
A | 将Fe加入CuSO4溶液中:Fe+Cu2+=== Cu+Fe2+ | 将Na加入到CuSO4溶液中:2Na+Cu2+=== Cu+2Na+ |
B | 向Ca(ClO)2溶液中通入少量CO2:CO2+H2O+Ca2++2ClO-=== CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:SO2+H2O+Ca2++2ClO-=== CaSO3↓+2HClO |
C | 惰性电极电解氯化钠溶液:2Cl-+2H2O | 惰性电极电解MgBr2溶液:2Br-+2H2O |
D | 稀盐酸与NaOH溶液反应至中性:H++OH-===H2O | 稀硝酸与Ba(OH)2溶液反应至中性:H++OH-===H2O |
A. A B. B C. C D. D
【题目】某混合溶液中,可能大量含有的离子如下表:
阳离子 | H+、K+、Al3+、NH |
阴离子 | OH-、SO42—、CO32—、AlO2— |
将Na2O2逐渐加入上述混合溶液中并微热,产生沉淀和气体如图所示。

下列说法不正确的是:
A. 上述混合溶液中一定大量含有H+、NH4+、Al3+、Mg2+、SO42—
B. 图中a=4
C. b=7;c=9
D. 此溶液还需要用焰色反应继续检验,才能确定溶液准确组成