题目内容
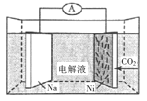
【题目】普通锌锰干电池的构造如图所示,其电池反应的方程式为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnO(OH)下列说法不正确的是( )

A.石墨作正极
B.锌发生氧化反应
C.电池工作时,电子从石墨经导线流向锌
D.正极的电极反应为:NH4++MnO2+e-=MnO(OH)+NH3
【答案】C
【解析】
分析电池反应方程式可知,Zn化合价升高,被氧化,发生氧化反应,MnO2化合价降低,被还原,发生还原反应。根据原电池中,负极发生氧化反应,正极发生还原反应,电子由负极经导线流向正极,电流与电子移动方向相反。据此分析解答。
A.根据原电池中一般活泼金属作负极,活泼性较弱的金属或非金属作正极,结合原电池的总反应式可知,石墨作正极,A项正确;
B.根据题中电池反应方程式可知,Zn化合价升高,被氧化,发生氧化反应,B项正确;
C.原电池中,电子从负极经导线流向正极,在该普通锌锰干电池中,Zn作负极,石墨作正极,电子应从Zn极经导线流向石墨,C项错误;
D.正极发生还原反应,其电极反应方程式为:NH4++MnO2+e-=MnO(OH)+NH3,D项正确;
答案选C。

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
【题目】某混合溶液中,可能大量含有的离子如下表:
阳离子 | H+、K+、Al3+、NH |
阴离子 | OH-、SO42—、CO32—、AlO2— |
将Na2O2逐渐加入上述混合溶液中并微热,产生沉淀和气体如图所示。
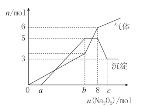
下列说法不正确的是:
A. 上述混合溶液中一定大量含有H+、NH4+、Al3+、Mg2+、SO42—
B. 图中a=4
C. b=7;c=9
D. 此溶液还需要用焰色反应继续检验,才能确定溶液准确组成