题目内容
【题目】金属钠元素、钴元素在工业上有重要的应用。请回答下列问题:
(1)Ca大于Co的是________(填标号)
A. 最外层电子数 B. 原子半径
C. 第一电离能 D. 未成对电子数
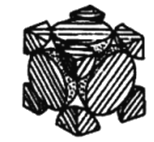
(2)经X射线衍射法测定发现,晶体钴在417℃以上堆积方式的剖面图如图所示,则该堆积方式属于_____,若该堆积方式下的晶胞参数为a cm,则钴原子的半径为______pm。
(3)Co3+氧化性极强,在水溶液中易被还原成Co2+,而在氨水中可稳定存在,其原因是________。
(4)已知:配合物中,配位体中含有一个配位原子的配体称为单齿配体;一个配体中有两个或两个以上配位原子的配体称为多齿配体。[Co(NO3—)4]2—中Co2+的配位数为4,该配离子中各元素第一电离能由大到小的顺序_______(填元素符号),1mol该离子中含σ键数目为_________。
(5)①Co的某配合物化学式为CoCl3·3NH3,为八面体结构,其中极性分子有___种。
②该配合物在热NaOH溶液中发生反应产生沉淀,并释放出气体,该反应的化学方程式_________。
(6)NaCl晶体在50~300GPa的高压下和Cl2反应,可以形成一种新晶体,其立方晶胞如下图所示(大球为Cl,小球为Na)。
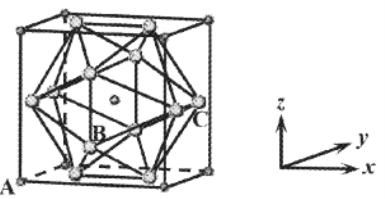
①若A的原子坐标为(0,0,0),C的原子坐标为(1,![]() ,
,![]() ),则B的原子坐标为________。
),则B的原子坐标为________。
②晶体中,Cl构成的多面体包含_____个三角形的面,与Cl紧邻的Na个数为______。
(7)钴蓝晶体结构如下图,该立方晶胞由I型和II型小立方体各4个构成,其化学式为_____,晶体中Al3+占据O2—形成的_____面体空隙,NA为阿伏伽德罗常数的值,设化学式对应的摩尔质量为Mg/mol,则钴蓝晶体的密度计算式为_________g/cm3。

【答案】B 面心立方堆积 ![]() a×1010 Co3+可与NH3(或一水合氨、OH—也可以)形成较稳定的配合物 N 、O、 Co或N >O>Co 16NA 2 CoCl3·3NH3+3NaOH
a×1010 Co3+可与NH3(或一水合氨、OH—也可以)形成较稳定的配合物 N 、O、 Co或N >O>Co 16NA 2 CoCl3·3NH3+3NaOH ![]() Co(OH)3↓+3 NH3↑+3NaCl (
Co(OH)3↓+3 NH3↑+3NaCl (![]() ,0,
,0,![]() ) 20 4 CoAl2O4 八 8M/[NA(2a×10—7)3]
) 20 4 CoAl2O4 八 8M/[NA(2a×10—7)3]
【解析】
本题以金属钠元素、钴元素为载体,考查了钠钴及其化合物的结构和性质。
(1)Ca原子基态电子排布式为[Ar]4s2,Co原子基态电子排布式为[Ar]3d74s2。A.根据核外电子排布式可知Ca和Co的最外层电子数均为2,A错误;B.Ca和Co的电子层数一样,但Co的核电荷数较大,因而对最外层电子的吸引力较大,原子半径较小,故Ca原子半径大于Co原子,B正确;C.同周期自左往右第一电离能变化有曲折,但整体趋势是第一电离能越来越大,故Ca的第一电离能比Co小,C错误;D. 根据核外电子排布式可知Ca原子没有未成对电子,而Co原子有3个未成对电子,Co的未成对电子数多于Ca,D错误。故答案选B。
(2)根据晶体钴在417℃以上堆积方式的剖面图易知该堆积方式为面心立方堆积,设面对角线长s,根据面心立方堆积特点可知s=4r,r为钴原子半径,又s=![]() ,带入数据可解得r=
,带入数据可解得r=![]() ×1010pm。
×1010pm。
(3)Co3+有空轨道,原因为Co3+可与NH3形成稳定的配合物,故答案为:Co3+可与NH3形成稳定的配合物。
(4)非金属越强,第一电离能越大,由于N的电子排布式是半充满稳定结构,所以第一电离能大于O,所以第一电离能由大到小的顺序为N、O、Co;硝酸根中σ键有3个,则一个[Co(NO3—)4]2—离子中含σ键数目为4+4×3=16,则1mol该配离子中含σ键数目为16NA。
(5)①Co的某配合物化学式为CoCl3·3NH3,为八面体结构,可推知其结构有两种,因为不能形成对称结构,其中极性分子也是2种;
②该配合物在热NaOH溶液中发生反应产生沉淀,该沉淀为Co(OH)3,并释放出气体,气体为氨气,因而化学方程式为CoCl3·3NH3+3NaOH ![]() Co(OH)3↓+3 NH3↑+3NaCl。
Co(OH)3↓+3 NH3↑+3NaCl。
(6)①观察立方晶胞可知,两个有一定间距的Cl(大球)处于每个面的中心,C的原子坐标为(1,![]() ,
,![]() ),观察C所处的面内,距离较远的棱的距离为
),观察C所处的面内,距离较远的棱的距离为![]() ,距离较近的棱的距离为1-
,距离较近的棱的距离为1-![]() =
=![]() ,类比C,可知B的坐标为(
,类比C,可知B的坐标为(![]() ,0,
,0,![]() );
);
②晶体中Cl构成的面均是正三角形,这样的三角形可计数有20个;以C处Cl为例,与之邻近的侧棱上有2个Na离Cl最近,假设晶胞长1,该距离易算得![]() ,这个距离恰好等于晶胞内体心Na与该Cl距离相等,该Cl为两个晶胞占有,因而有两个体心Na与该Cl紧邻,合计2+2=4个。
,这个距离恰好等于晶胞内体心Na与该Cl距离相等,该Cl为两个晶胞占有,因而有两个体心Na与该Cl紧邻,合计2+2=4个。
(7)观察黑色小球Co可知有两类Co,一类位于棱上有12×![]() =3个,另一类在晶胞内,体心有1个Co,而每个I型中含有1个Co,晶胞有4个I型,因而I型含Co共计4个,晶胞内Co合计3+1+4=8个,I型和II型合起来的长方体中含有4个Al和8个O,晶胞内有4个I型和II型合起来的长方体,因而晶胞内总计有16个Al和32个O,Co、Al、O个数比为8:16:32=1:2:4,化学式为CoAl2O4;距离O2-最近的Al3+有6个,结合晶胞分析可知,6个Al3+组成八面体,因而晶体中Al3+占据O2—形成八面体空隙;每个晶胞内相当于拥有8个CoAl2O4,因而晶胞微粒质量m=
=3个,另一类在晶胞内,体心有1个Co,而每个I型中含有1个Co,晶胞有4个I型,因而I型含Co共计4个,晶胞内Co合计3+1+4=8个,I型和II型合起来的长方体中含有4个Al和8个O,晶胞内有4个I型和II型合起来的长方体,因而晶胞内总计有16个Al和32个O,Co、Al、O个数比为8:16:32=1:2:4,化学式为CoAl2O4;距离O2-最近的Al3+有6个,结合晶胞分析可知,6个Al3+组成八面体,因而晶体中Al3+占据O2—形成八面体空隙;每个晶胞内相当于拥有8个CoAl2O4,因而晶胞微粒质量m=![]() g,晶胞体积V=(2a×10-7)3cm3,密度等于
g,晶胞体积V=(2a×10-7)3cm3,密度等于![]() =
=![]() g/cm3。
g/cm3。