题目内容
8.设NA代表阿伏加德罗常数的值,下列叙述正确的是( )| A. | 71gCl2中含有NA个Cl2分子 | |
| B. | 常温常压下,14g氮气中含有2NA个氮原子 | |
| C. | 0.5mol•L-1CaCl2溶液中含有0.5NA个Ca2+ | |
| D. | 标准状况下,33.6L水中含有1.5NA个水分子 |
分析 A、求出氯气的物质的量,然后根据分子个数N=nNA来分析;
B、氮气由氮原子构成;
C、溶液体积不明确;
D、标况下水为液态.
解答 解:A、71g氯气的物质的量为1mol,故含有的分子个数N=nNA=NA 个,故A正确;
B、氮气由氮原子构成,故14g氮气中含有的氮原子的个数N=$\frac{14g}{14g/mol}$=1mol,故为NA个,故B错误;
C、溶液体积不明确,故溶液中的钙离子的个数无法计算,故C错误;
D、标况下水为液态,不能根据气体摩尔体积来计算其物质的量,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.为了测定某镁铝合金样品中的含量,进行下列实验,取一定量合金,加入100ml0.3mol/L的稀硫酸,合金全部溶解,产生的气体在标况下的体积为560ml,再加入0.2mol/L的NaOH溶液至沉淀质量恰好不再变化,用去350mlNaOH溶液,则所取样品中铝的质量是( )
| A. | 1.35g | B. | 0.27g | C. | 0.54g | D. | 2.7g |
19.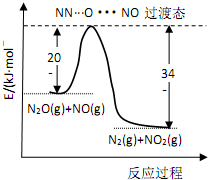 由 N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法正确的是( )
由 N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法正确的是( )
 由 N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法正确的是( )
由 N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法正确的是( )| A. | 由图分析 N2O(g) 的能量一定高于 NO2(g)+N2(g) | |
| B. | 反应过程中没有发生化学键的断裂和化学键的生成 | |
| C. | 若生成 1mol N2(g),其△H=-139kJ•mol-1 | |
| D. | 由图可知 N2+NO2=N2O+NO△H=+139kJ•mol-1, 若使用催化剂还可以减小反应的热效应 |
16.下列离子方程式的书写正确的是( )
| A. | 实验室用浓盐酸与MnO2反应制Cl2:MnO2+4HCl(浓)$\frac{\underline{\;△\;}}{\;}$Cl2↑+Mn2++2Cl-+2H2O | |
| B. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至Ba2+刚好沉淀完全:Ba2++2OH-+H++${SO}_{4}^{2-}$+${NH}_{4}^{+}$═BaSO4↓+NH3•H2O+H2O | |
| C. | 向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:Ca2++${HCO}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| D. | 将标准状况下112mL氯气通入10mL、1 mol/L的溴化亚铁溶液中:2Br-+Cl2═2Cl-+Br2 |
3.某同学实验需要450mL0.1mol•L-1碳酸钠溶液,配制该溶液时下列仪器不需要的是( )
| A. | 100mL量筒、烧杯、玻璃棒 | B. | 托盘天平、500mL容量瓶 | ||
| C. | 酒精灯、三角漏斗、导管 | D. | 胶头滴管、玻璃棒、烧杯 |
17.下列电离方程式正确的是( )
| A. |  ? ?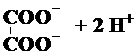 | B. | Ba(OH)2?Ba2++2OH- | ||
| C. | HCO3-+H2O?H3O++CO32- | D. | NaHCO3═Na++H++CO32- |

 宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其构造如图所示,A、B是多孔性炭制成的两个电极,通入的气体由孔隙中逸出,并在电极表面放电.
宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其构造如图所示,A、B是多孔性炭制成的两个电极,通入的气体由孔隙中逸出,并在电极表面放电.