题目内容
18.为了测定某镁铝合金样品中的含量,进行下列实验,取一定量合金,加入100ml0.3mol/L的稀硫酸,合金全部溶解,产生的气体在标况下的体积为560ml,再加入0.2mol/L的NaOH溶液至沉淀质量恰好不再变化,用去350mlNaOH溶液,则所取样品中铝的质量是( )| A. | 1.35g | B. | 0.27g | C. | 0.54g | D. | 2.7g |
分析 镁铝合金与硫酸反应生成硫酸镁、硫酸铝与氢气,向反应后的溶液中加入0.2 mol•L-1 NaOH溶液至沉淀质量恰好不再变化,铝离子转化为偏铝酸根、镁离子转化为氢氧化镁沉淀,此时溶液中溶质为Na2SO4、NaAlO2,根据硫酸根守恒有n(Na2SO4)=n(H2SO4),根据钠离子守恒有n(NaOH)=2n(Na2SO4)+n(NaAlO2),据此计算n(NaAlO2),再根据铝原子守恒n(Al)=n(NaAlO2),最后根据m=nM计算出铝的质量.
解答 解:镁铝合金与硫酸反应生成硫酸镁、硫酸铝与氢气,向反应后的溶液中加入0.2 mol•L-1 NaOH溶液至沉淀质量恰好不再变化,铝离子转化为偏铝酸根、镁离子转化为氢氧化镁沉淀,此时溶液中溶质为Na2SO4、NaAlO2,
根据硫酸根守恒可知:n(Na2SO4)=n(H2SO4)=0.1L×0.3mol/L=0.03mol,
根据钠离子守恒可知:n(NaOH)=2n(Na2SO4)+n(NaAlO2),故n(NaAlO2)=0.35L×0.2mol/L-0.03mol×2=0.01mol,
根据铝原子守恒可得:n(Al)=n(NaAlO2)=0.01mol,
所以所取样品中铝的质量为:27g/mol×0.01mol=0.27g,
故选B.
点评 本题考查混合物反应的有关计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学中的应用方法,试题培养了学生的化学计算能力.

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
13.下列溶液因水解显碱性的是( )
| A. | 碳酸钠 | B. | 硝酸钠 | C. | 石灰水 | D. | 氯化铜 |
10.某工业废水中可能含有如下几种阴阳离子:
现对该废水样品进行以下研究:
Ⅰ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅱ.若向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成.
Ⅲ.若向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成.过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成.
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是NO3- SO42-,一定不含有的阳离子是Ba2+;
(2)写出Ⅲ的所得滤液中通入过量的CO2气体生成白色絮状沉淀的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)已知用铝粉可以除去废水中的一种阴离子(X).若控制溶液的pH为10.7左右,再加入铝粉,除去X离子的同时产生氨气和氮气,且体积比为1﹕4,完成下列反应的离子方程式并配平:(X用具体的离子符号表示)
Al+X+OH-=AlO2-+NH3+N2+16Al+9NO3-+7OH-=16AlO2-+NH3↑+4N2↑+2H2O
该反应的还原产物是NH3、N2.
若除去0.2mol X离子,要消耗铝9.6g.
| 阳离子 | Fe3+、Al3+、Fe2+、Ba2+、Na+ |
| 阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
Ⅰ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅱ.若向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成.
Ⅲ.若向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成.过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成.
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是NO3- SO42-,一定不含有的阳离子是Ba2+;
(2)写出Ⅲ的所得滤液中通入过量的CO2气体生成白色絮状沉淀的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)已知用铝粉可以除去废水中的一种阴离子(X).若控制溶液的pH为10.7左右,再加入铝粉,除去X离子的同时产生氨气和氮气,且体积比为1﹕4,完成下列反应的离子方程式并配平:(X用具体的离子符号表示)
Al+X+OH-=AlO2-+NH3+N2+16Al+9NO3-+7OH-=16AlO2-+NH3↑+4N2↑+2H2O
该反应的还原产物是NH3、N2.
若除去0.2mol X离子,要消耗铝9.6g.
8.设NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 71gCl2中含有NA个Cl2分子 | |
| B. | 常温常压下,14g氮气中含有2NA个氮原子 | |
| C. | 0.5mol•L-1CaCl2溶液中含有0.5NA个Ca2+ | |
| D. | 标准状况下,33.6L水中含有1.5NA个水分子 |

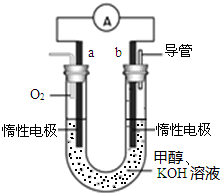 (1)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是b
(1)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是b
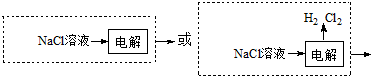 .
.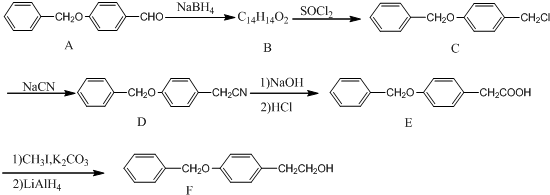
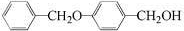 ;由A→B的反应类型是:还原反应.
;由A→B的反应类型是:还原反应.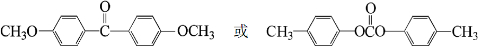 .
. 为原料制备化合物X(
为原料制备化合物X(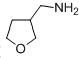 )(结构简式见图)的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:
)(结构简式见图)的合成路线流程图(无机试剂可任选).合成路线流程图示例如下: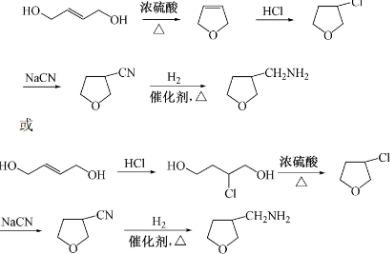 .
.
 .
.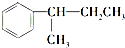 $\stackrel{酸性KMnO_{4}溶液}{→}$
$\stackrel{酸性KMnO_{4}溶液}{→}$ .
.