题目内容
17.下列电离方程式正确的是( )| A. | 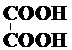 ? ? | B. | Ba(OH)2?Ba2++2OH- | ||
| C. | HCO3-+H2O?H3O++CO32- | D. | NaHCO3═Na++H++CO32- |
分析 分清电解质的强弱,强电解质在水溶液里完全电离生成阴阳离子,电离方程式写“=”,弱电解质在水溶液里部分电离,电离方程式写“?”,书写时要遵循原子守恒、电荷守恒,据此分析解答.
解答 解:A、酸是二元弱酸存在电离平衡,分步电离,电离方程式为:H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-,故A错误;
B、氢氧化钡为强碱,是强电解质,完全电离,故用等号,故B错误;
C、由于碳酸是二元弱酸,不能完全电离,故HCO3-在水分子的作用下部分电离为CO32-,故电离方程式为:HCO3-+H2O?H3O++CO32-,故C正确;
D、由于碳酸是二元弱酸,不能完全电离,故HCO3-在水分子的作用下只能部分电离为CO32-,即NaHCO3只能完全电离为Na+和HCO3-,即正确的离子方程式为:NaHCO3=Na++CO3-,故D错误.
故选C.
点评 本题考查了电离方程式的书写,明确电解质的强弱及电离方程式的书写规则是解本题关键,注意HCO3-原子团不能拆,题目难度不大.

练习册系列答案
相关题目
8.设NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 71gCl2中含有NA个Cl2分子 | |
| B. | 常温常压下,14g氮气中含有2NA个氮原子 | |
| C. | 0.5mol•L-1CaCl2溶液中含有0.5NA个Ca2+ | |
| D. | 标准状况下,33.6L水中含有1.5NA个水分子 |
5.下列过程中,共价键被破坏,不能说明有分子间作用力的存在的是( )
| A. | 碘升华 | B. | HI气体受热分解 | ||
| C. | 食盐熔化 | D. | 液氯汽化要吸收一定的能量 |
12.乙醇是重要的有机化工原料,可由乙烯直接水合法或间接水合法生产.回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H).再水解生成乙醇.写出相应的反应的化学方程式CH2=CH2+H2SO4=C2H5OSO3H、C2H5OSO3H+H2O→C2H5OH+H2SO4.
(2)已知:
甲醇脱水反应①2CH3OH(g)═CH3OCH3(g)+H2O(g)?△H1=-23.9KJ•mol-1
甲醇制烯烃反应②2CH3OH(g)═C2H4 (g)+2H2O(g)?△H2=-29.1KJ•mol-1
乙醇异构化反应③CH3CH2OH(g)═CH3OCH3(g)?△H3=+50.7KJ•mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)═C2H5OH(g)的?△H=-45.5KJ•mol-1
与间接水合法相比,气相直接水合法的优点是:无副产品,原子利用率100%.
(3)科学家还利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为2CO2(g)+
6H2(g)?CH3CH2OH(g)+3H2O(g)△H=a kJ/mol,在一定压强下,测得该反应的实验数据如下表.
请根据表中数据分析:上述反应的a小于0(填“大于”或“小于”
②恒温下,向反应体系中加入固体催化剂,则反应产生的热量不变(填“增大”、“减小”或“不变”).
③增大$\frac{n({H}_{2})}{n(C{O}_{2})}$的值,则生成乙醇的物质的量不能确定(填“增大”、“减小”、“不变”或“不能确定”).
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H).再水解生成乙醇.写出相应的反应的化学方程式CH2=CH2+H2SO4=C2H5OSO3H、C2H5OSO3H+H2O→C2H5OH+H2SO4.
(2)已知:
甲醇脱水反应①2CH3OH(g)═CH3OCH3(g)+H2O(g)?△H1=-23.9KJ•mol-1
甲醇制烯烃反应②2CH3OH(g)═C2H4 (g)+2H2O(g)?△H2=-29.1KJ•mol-1
乙醇异构化反应③CH3CH2OH(g)═CH3OCH3(g)?△H3=+50.7KJ•mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)═C2H5OH(g)的?△H=-45.5KJ•mol-1
与间接水合法相比,气相直接水合法的优点是:无副产品,原子利用率100%.
(3)科学家还利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为2CO2(g)+
6H2(g)?CH3CH2OH(g)+3H2O(g)△H=a kJ/mol,在一定压强下,测得该反应的实验数据如下表.
| 温度(K) CO2转化率(%) $\frac{n({H}_{2})}{n(C{O}_{2})}$ | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
②恒温下,向反应体系中加入固体催化剂,则反应产生的热量不变(填“增大”、“减小”或“不变”).
③增大$\frac{n({H}_{2})}{n(C{O}_{2})}$的值,则生成乙醇的物质的量不能确定(填“增大”、“减小”、“不变”或“不能确定”).
2.三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物.探究过程如下:
【查阅资料】:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,Cu2O在空气中加热生成CuO
【提出假设】
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
【设计探究实验】
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是固体完全溶解,溶液变为血红色.
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?不合理.
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是Fe2O3和Cu2O的混合物,写出发生反应的离子方程式Cu2O+2H+═Cu+Cu2++H2O、2Fe3++Cu═2Fe2++Cu2+.
探究延伸
经实验分析确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为$\frac{9(b-a)}{a}$×100%.
(5)欲利用红色粉末Fe2O3和Cu2O的混合物制取较纯净的胆矾 (CuSO4.5H2O)经查阅资料得知,在溶液中调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH
实验室有下列试剂可供选择:
A.氯水 B.H2O2 C.硝酸 D.NaOH E.氨水 F.Cu2(OH)2CO3
实验小组设计如下实验方案:

试回答:①试剂I为B,试剂II为F(填字母).
②固体X的化学式为Fe(OH)3.
【查阅资料】:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,Cu2O在空气中加热生成CuO
【提出假设】
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
【设计探究实验】
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是固体完全溶解,溶液变为血红色.
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?不合理.
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是Fe2O3和Cu2O的混合物,写出发生反应的离子方程式Cu2O+2H+═Cu+Cu2++H2O、2Fe3++Cu═2Fe2++Cu2+.
探究延伸
经实验分析确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为$\frac{9(b-a)}{a}$×100%.
(5)欲利用红色粉末Fe2O3和Cu2O的混合物制取较纯净的胆矾 (CuSO4.5H2O)经查阅资料得知,在溶液中调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
A.氯水 B.H2O2 C.硝酸 D.NaOH E.氨水 F.Cu2(OH)2CO3
实验小组设计如下实验方案:

试回答:①试剂I为B,试剂II为F(填字母).
②固体X的化学式为Fe(OH)3.
6.(Ⅰ)室温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?a=7时,HA是强酸;a>7时,HA是弱酸
(2)乙组混合溶液中c(A-)和c(Na+)的大小关系是C
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+)
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=10-4-10-10mol/L.
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
H2B═H++HB- HB-?H++B2-
回答下列问题:
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是AC.
A.c(B2-)+c(HB-)=0.1mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
( III)已知:25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9.
(6)医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂.胃酸酸性很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释)对于平衡BaSO4(s)?Ba2+(aq)+SO42-(aq),H+不能减少Ba2+或SO42-的浓度,平衡不能向溶解方向移动.
万一误服了少量BaCO3,应尽快用大量0.5mol/L Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为2×10-10mol/L.
| 实验 编号 | HA的物质的量 浓度(mol/L) | NaOH的物质的 量浓度(mol/L) | 混合后 溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(2)乙组混合溶液中c(A-)和c(Na+)的大小关系是C
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+)
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=10-4-10-10mol/L.
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
H2B═H++HB- HB-?H++B2-
回答下列问题:
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是AC.
A.c(B2-)+c(HB-)=0.1mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
( III)已知:25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9.
(6)医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂.胃酸酸性很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释)对于平衡BaSO4(s)?Ba2+(aq)+SO42-(aq),H+不能减少Ba2+或SO42-的浓度,平衡不能向溶解方向移动.
万一误服了少量BaCO3,应尽快用大量0.5mol/L Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为2×10-10mol/L.
3.能正确表示下列反应的离子方程式是( )
| A. | 向NaOH溶液中通入过量的CO2:CO2+OH-═HCO3- | |
| B. | 将SO2气体通入Ba(NO3)2溶液:SO2+H2O+Ba2+═BaSO3↓+2H+ | |
| C. | 实验室制氯气:MnO2+4HCl(浓)═Mn2++2Cl2↑+2H2O | |
| D. | AlCl3溶液与过量氨水混合:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
 .
. $\stackrel{酸性KMnO_{4}溶液}{→}$
$\stackrel{酸性KMnO_{4}溶液}{→}$ .
. .
.