题目内容
【题目】某研究小组从甲苯出发,按下列路线合成染料中间体X和医药中间体Y。

已知:①化合物A、E、F互为同分异构体。

请回答:
(1)下列说法不正确的是_____________。
A.化合物C能发生氧化反应,不发生还原反应 B.化合物D能发生水解反应
C.化合物E能发生取代反应 D.化合物F能形成内盐
(2)B+C→D的化学方程式是____________________________________________。
(3)化合物G的结构简式是___________________。
(4)写出同时符合下列条件的A的所有同分异构体的结构筒式___________。
①红外光谱检测表明分子中含有醛基,②1H-NMR谱显示分子中含有苯环,目苯环上有两种不同化学环境的氢原子。
(5)为探索新的合成路线,采用苯和乙烯为原料制备化台物F,请设计该合成路线(用流程图表示,无机试剂任选)___________。
【答案】 A  NH2-CHO
NH2-CHO 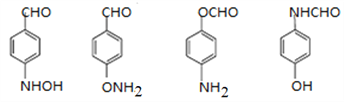

【解析】由转化关系可知A→B为甲基被氧化生成羧基,根据已知信息可知由X可知C为![]() ,B为
,B为![]() ,A为
,A为![]() ,则D为
,则D为 ,化合物A、E、F互为同分异构体,结合Y的结构分析可知硝基在邻位,为邻硝基甲苯,E结构简式为
,化合物A、E、F互为同分异构体,结合Y的结构分析可知硝基在邻位,为邻硝基甲苯,E结构简式为![]() ,F为
,F为![]() ,G为NH2-CHO,据此解答。
,G为NH2-CHO,据此解答。
(1)A.化合物C为![]() ,不能发生氧化反应,能发生还原反应,硝基被还原为氨基,A错误;B.化合物D为
,不能发生氧化反应,能发生还原反应,硝基被还原为氨基,A错误;B.化合物D为 ,分子结构中存在肽键,能发生水解反应,B正确;C.化合物E为
,分子结构中存在肽键,能发生水解反应,B正确;C.化合物E为![]() ,一定条件下能发生取代反应,如甲基上氢原子被取代,苯环上氢原子被取代,C正确;D.化合物F为
,一定条件下能发生取代反应,如甲基上氢原子被取代,苯环上氢原子被取代,C正确;D.化合物F为![]() ,分子中羧基和氨基缩水能形成内盐,D正确;答案选A.
,分子中羧基和氨基缩水能形成内盐,D正确;答案选A.
(2)B+C→D的化学方程式是 ;
;
(3)化合物G的结构简式是NH2-CHO;
(4)根据条件:①红外光谱检测表明分子中含有醛基;②1H-NMR谱显示分子中含有苯环,且苯环上有两种不同化学环境的氢原子.则符合条件的A的所有同分异构体的结构简式是 ;
;
(5)苯和乙烯为原料制备化合物F,苯先与乙烯发生加成反应生成苯乙烷,然后发生硝化生成邻硝基乙苯,最后氧化生成![]() ,合成路线为
,合成路线为 。
。

 名校课堂系列答案
名校课堂系列答案【题目】I.常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①、②、③的实验,实验数据记录如下表。
序号 | HA物质的量浓度(molL-1) | NaOH物质的量浓度(molL-1) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
(1)根据①组实验情况,分析混合溶液的pH=9的原因是______________________(用离子方程式表示),在该溶液中下列关系式错误的是________________(填标号)。
a.c(Na+)+c(H+)=c(OH-)+c(A-) b.c(Na+)=c(HA)+c(A-)
c.c(HA)+c(H+)=c(OH-) d.c(Na+)+c(H+)=c(OH-)+c(A-)+c(HA)
(2)②组情况表明,c______0.2(填“>”“<”或“=”,下同),混合溶液中:c(A-)_______c(Na+)。
(3)从③组实验结果分析,说明HA的电离程度_____NaA的水解程度(填“>”“<”或“=”),离子浓度由大到小的顺序是_______________________________。
Ⅱ.室温下,若将0.1 molL-1盐酸滴入20mL0.1 molL-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示:

(1)NH3·H2O的电离方程式是_______________________________。
(2)b点所示溶液中的溶质是_______________________________。
(3)c点所示溶液中,离子浓度从大到小的关系为_______________________________。
【题目】(1)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
①0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”“小于”或“等于”)
②若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____。(选填编号)
A.[H+]>[HC2O4-]>[HCO3-]>[CO32-] B.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
C.[H+]>[HC2O4-]>[C2O42-]>[CO32-] D.[H2CO3] >[HCO3-]>[HC2O4-]>[CO32-]
(2)白磷与氧气可发生如下反应:P4+5O2= P4O10。已知断裂下列化学键需要吸收的能量分别为: P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH=___________。

(3)25 ℃,某浓度的盐酸、氯化铵溶液中由水电离出的氢离子浓度分别为1.0×10-amol·L-1、1.0×10-b mol·L-1,这两种溶液的pH之和=___________。
(4)在t ℃时,某Ba(OH)2的稀溶液中c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸,测得混合溶液的部分pH如下表所示:
序号 | 氢氧化钡溶液 的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 8 |
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c=___________。