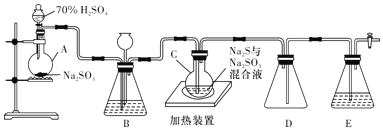
��Ŀ����
����Ŀ��ijͬѧ����Ӧ2Fe3++2I-=2Fe2++I2��Ƴ���ͼ��ʾ��ԭ���:

ʵ�鲽�輰��������:
�ٱպϿ��أ�ָ�뷢��ƫת���������ƶ�����С����������Ϊ��ʱ������;
��ȡ�������ձ�����Һ������3~4�ε�����Һ����Һ����ɫ;
��ȡ�������ձ�����Һ������3~4��KSCN��Һ����Һ��Ѫ��ɫ;
�������ձ��м�������FeCl2���壬�ٴαպϿ��أ�ָ������ƫת(��������Ϊ��)��
���������ϡ�����������ָ������ƫ���Դ������ԭ����д������裬��Ӱ�췴Ӧ���̡�
��ش�:
(1)������У���ʼʱָ����_____(���"���ҡ�)ƫת�����ձ��з����ĵ缫��Ӧʽ____________________��
(2)������ٺ����ձ���Һ����������������____________(�����ӷ���)��
(3)�������ָ������ƫת�����ձ��з����ĵ缫��Ӧʽ______________________��
(4)Ҫ֤��2Fe3++2I-![]() 2Fe2++I2 Ϊ���淴Ӧ������Ϊ����ʵ�鲽�費��������______________(�����)��
2Fe2++I2 Ϊ���淴Ӧ������Ϊ����ʵ�鲽�費��������______________(�����)��
���𰸡� �� 2I--2e-=I2 Fe2+��K+ Fe2+-e-=Fe3+ �ڢ�
��������(1) �����ܷ�Ӧ2Fe3++2I-=2Fe2++I2�����ձ���ʯīΪ������ͼ�����������Ƶ�ָ��ָ����ƫת������ʯī�缫�ϵĵ缫��ӦʽΪ2I--2e-=I2���ʴ�Ϊ���ң�2I--2e-=I2��
(2)������ٺ����ձ��з�����ԭ��Ӧ�����������ӣ�ͬʱ�����м������������ձ������ձ���Һ������������������Fe2+��K+���ʴ�Ϊ��Fe2+��K+��
(3)�������ָ������ƫת��˵�����ձ���ʯīΪ���������ձ��з���������Ӧ���缫��ӦʽΪFe2+-e-=Fe3+���ʴ�Ϊ��Fe2+-e-=Fe3+��
(4)��������ʵ��٣�����֤�����ڷ�Ӧ2Fe3++2I-��2Fe2++I2������ʵ��ܣ�����֤�����ڷ�Ӧ2Fe2++I2��2Fe3++2I-��˵����Ӧ2Fe3++2I-=2Fe2++I2Ϊ���淴Ӧ��ʵ�鲽��ں͢۲��������ʴ�Ϊ���ڢ���

����Ŀ����Դ�����ͬ��ע����Ҫ���⡣ҳ�����Ǵ�ҳ�Ҳ��п��ɳ�����һ�ַdz���Ҫ����Ȼ����Դ��ҳ��������Ҫ�ɷ��Ǽ��飬�ǹ��ϵĽྻ��Դ��
��1��ҳ��������������ȼ�ϣ��������������ϳ���(CO��H2)��CH4��H2O(g)ͨ��۽�̫���ܷ�Ӧ����������Ӧ CH4(g)+H2O(g)=CO(g)+3H2(g)��H1
��֪����CH4��H2��CO ��ȼ���ȣ���H���ֱ�Ϊ-a kJmol-1��-b kJmol-1��-c kJmol-1��
��H2O (l) =H2O(g)�� ��H=+dkJmol-1
����H1= ___________���ú���ĸa��b��c��d�Ĵ���ʽ��ʾ��kJmol-1��
��2���úϳ������ɼ״��ķ�ӦΪ��CO(g)+2H2(g)![]() CH3OH(g) ��H2����10L�����ܱ������а����ʵ���֮��1��2����CO��H2�����CO��ƽ��ת�������¶Ⱥ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��200��ʱn(H2)��ʱ��ı仯���±���ʾ��
CH3OH(g) ��H2����10L�����ܱ������а����ʵ���֮��1��2����CO��H2�����CO��ƽ��ת�������¶Ⱥ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��200��ʱn(H2)��ʱ��ı仯���±���ʾ��

t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
�١�H2_________ (����>����<������ = ��)0��
������˵����ȷ����____________ (���ţ���
a.�¶�Խ�ߣ��÷�Ӧ��ƽ�ⳣ��Խ��
b.��ƽ����ٳ���ϡ�����壬CO��ת�������
c.����������ѹǿ���ٱ仯ʱ����Ӧ�ﵽ�����
d.ͼ��ѹǿp1<p2
�� 03 min����CH3OH��ʾ�ķ�Ӧ����v(CH3OH)=________mol L-1��min-1��
�� 200��ʱ���÷�Ӧ��ƽ�ⳣ��K =_______��������200���ﵽƽ��ĺ����ܱ��������ټ���2 mol CO��2 mol H2��2 mol CH3OH�������¶Ȳ��䣬��ѧƽ��____________(����������������������������)�ƶ���
��3�����顢������KOH��Һ�����ȼ�ϵ�ء���״����ͨ��5.6 L���飬��õ�·��ת��1.2 mol���ӣ�������������Ϊ_________��
����Ŀ����A��B��C��D����ǿ����ʣ�������ˮ�е���ʱ�ɲ�����������(ÿ������ֻ��һ���������һ����ظ�)��
������ | Na+��Ba2+��NH4+ |
������ | CO32-��Cl-��OH-��SO42- |
��֪:
�ٳ�����A��C��ҺpH������7��B��ҺpHС��7��D��ҺpH����7;
��C��Һ��D��Һ���ֻ������ɫ����;
��B��Һ��C��Һ��Ϲ���ʱֻ�����̼�����ζ������;
��A��Һ��D��Һ���ʱ����������
��ش�:
(1)D�Ļ�ѧʽ_______________________��
(2)ʵ��۷�Ӧ�����ӷ���ʽ_______________________��
(3)��B��C��D��ѡȡ���ʣ����ʵ�鷽��ȷ��A�����_______________________��