题目内容
【题目】(1)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
①0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”“小于”或“等于”)
②若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____。(选填编号)
A.[H+]>[HC2O4-]>[HCO3-]>[CO32-] B.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
C.[H+]>[HC2O4-]>[C2O42-]>[CO32-] D.[H2CO3] >[HCO3-]>[HC2O4-]>[CO32-]
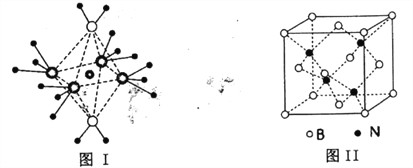
(2)白磷与氧气可发生如下反应:P4+5O2= P4O10。已知断裂下列化学键需要吸收的能量分别为: P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH=___________。

(3)25 ℃,某浓度的盐酸、氯化铵溶液中由水电离出的氢离子浓度分别为1.0×10-amol·L-1、1.0×10-b mol·L-1,这两种溶液的pH之和=___________。
(4)在t ℃时,某Ba(OH)2的稀溶液中c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸,测得混合溶液的部分pH如下表所示:
序号 | 氢氧化钡溶液 的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 8 |
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c=___________。
【答案】 > AC (6a+5d-4c-12b) kJ·mol-1 14-a+b 4
【解析】(1) ①根据电离常数可知,草酸的酸性强于碳酸,则碳酸钠的水解程度大于草酸钠,所以0.1 mol/L Na2CO3溶液的pH大于0.1 mol/L Na2C2O4溶液的pH;②草酸的二级电离常数大于碳酸的,所以草酸的电离程度大于碳酸,且碳酸以第一步电离为主,因此溶液中[H+]>[HC2O4-]>[C2O42-]>[HCO3-]>[CO32-],A.c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-),选项A正确;B.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-),选项B错误;C.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-),选项C正确;D.c(H2CO3)>c(HCO3-)>c(HC2O4-)>c(CO32-),选项D错误。答案选AC;(2)根据P4+5O2=P4O10,反应的焓变等于反应物的键能总和减去生成物的键能总和,P4中有6个P—P ,5O2有5个O=O,P4O10有4个P=O和12个P—O ,所以白磷与氧反应的△H为(6a+5d-4c-12b)kJ·mol—1;(3)盐酸抑制水的电离,水电离出的氢离子浓度为1.0×10-amolL-1,则c(H+)=![]() =1.0×10a-14mol/L,溶液pH=14-a,氯化铵水解呈酸性,促进水的电离,如水电离出的氢离子浓度1.0×10-bmolL-1,则c(H+)=1.0×10-bmolL-1,溶液pH=b,则这两种溶液的pH之和为14-a+b;(4)Ba(OH)2溶液的pH=8,即a=8,再根据a+b=12,则b=4,该温度下KW=10-12mol2/L2;当恰好完全中和时,溶液的pH=6,即加盐酸的体积为22.00 mL时,恰好完全中和,根据c(H+)×22.00 mL=c(OH-)×22.00 mL,又c(OH-)=10-4mol/L,则盐酸c(H+)=10-4mol/L,pH=4,即c=4。
=1.0×10a-14mol/L,溶液pH=14-a,氯化铵水解呈酸性,促进水的电离,如水电离出的氢离子浓度1.0×10-bmolL-1,则c(H+)=1.0×10-bmolL-1,溶液pH=b,则这两种溶液的pH之和为14-a+b;(4)Ba(OH)2溶液的pH=8,即a=8,再根据a+b=12,则b=4,该温度下KW=10-12mol2/L2;当恰好完全中和时,溶液的pH=6,即加盐酸的体积为22.00 mL时,恰好完全中和,根据c(H+)×22.00 mL=c(OH-)×22.00 mL,又c(OH-)=10-4mol/L,则盐酸c(H+)=10-4mol/L,pH=4,即c=4。

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案