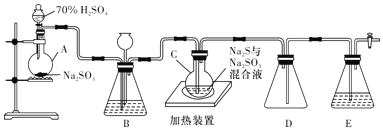
题目内容
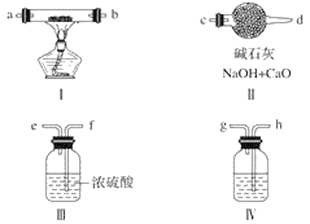
【题目】现用金属钠和空气制备纯度较高的过氧化钠,可利用的装置如下图所示。
请回答下列问题:
(1)装置Ⅳ中盛放的药品是______________,其作用是______________。
(2)若规定气体的气流方向从左到右,则组合实验装置时各件仪器的正确连接顺序为(按从左到右顺序写明仪器的编号Ⅰ、Ⅱ……)______________,各仪器接口的标号字母(a、b……)顺序是空气进入__________,接__________,接__________,接__________。______________
(3)装置Ⅱ的作用是______________________________________。
【答案】氢氧化钠溶液 吸收空气中的二氧化碳 Ⅳ、Ⅲ、Ⅰ、Ⅱ hg fe ab c 防止空气中的水分和二氧化碳倒吸进入装置Ⅰ
【解析】
用金属钠和空气制备纯度较高的Na2O2,需要空气中的氧气和钠加热反应生成过氧化钠,空气中的水蒸气和二氧化碳需要除去;通过装置Ⅳ吸收空气中的二氧化碳气体,再通过装置Ⅲ吸收水蒸气,通过装置Ⅰ加热钠和氧气反应,连接装置Ⅱ防止空气中的二氧化碳和水蒸气进入装置Ⅰ,得不到纯净的过氧化钠,据此解答。
(1)由于空气中含有二氧化碳,二氧化碳能与过氧化钠反应,则需要除去空气中的二氧化碳,因此装置Ⅳ中盛放NaOH溶液,其作用是吸收空气中的二氧化碳;
(2)用金属钠和空气制备纯度较高的Na2O2,需要空气中的氧气和钠加热反应生成过氧化钠,空气中的水蒸气和二氧化碳需要除去;通过装置Ⅳ吸收空气中的二氧化碳气体,再通过装置Ⅲ吸收水蒸气,通过装置Ⅰ加热钠和氧气反应,连接装置Ⅱ防止空气中的二氧化碳和水蒸气进入装置Ⅰ,得不到纯净的过氧化钠,因此实验装置时各仪器的正确连接顺序为Ⅳ、Ⅲ、Ⅰ、Ⅱ,则各仪器接口的标号字母顺序为:空气→h→g→f→e→a(或b)→b(或a)→c→d:
(3)装置Ⅱ中盛放碱石灰是吸收二氧化碳和水蒸气,其作用是防止空气中的二氧化碳和水蒸气进入装置Ⅰ。

 阅读快车系列答案
阅读快车系列答案【题目】能源是人类共同关注的重要问题。页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应 CH4(g)+H2O(g)=CO(g)+3H2(g)△H1
已知:①CH4、H2、CO 的燃烧热(△H)分别为-a kJmol-1、-b kJmol-1、-c kJmol-1;
②H2O (l) =H2O(g); △H=+dkJmol-1
则△H1= ___________(用含字母a、b、c、d的代数式表示)kJmol-1。
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:

t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①△H2_________ (填“>”“<”或“ = ”)0。
②下列说法正确的是____________ (填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③ 03 min内用CH3OH表示的反应速率v(CH3OH)=________mol L-1·min-1。
④ 200℃时,该反应的平衡常数K =_______。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡____________(填“正向”、“逆向”或“不”)移动。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6 L甲烷,测得电路中转移1.2 mol电子,则甲烷的利用率为_________。