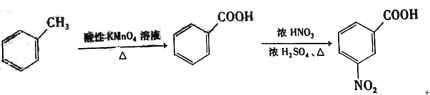
题目内容
【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g)Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如表
T/K | 938 | 1100 |
K | 0.68 | 0.40 |
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态、若降低温度,混合气体的平均相对分子质量__________________;充入氮气,混合气体的密度__________________(填“增大”“减小”或“不变”)。
(2)常温下,浓度均为0.1mol·的下列五种溶液的pH如下表
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①上述盐溶液中的阴离子,水解能力最弱的是__________________。
②根据表中数据判断,浓度均为0.01mol·L-1的下列四种物质的溶液分别稀释100倍,pH变化最小的是_______(填编号)
A. HClO B. HCN C.H2CO3 D. CH3COOH
③据上表数据,请你判断下列反应不能成立的是_______(填编号)
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
④要增大氯水中HClO的浓度,可向氯水中加入碳酸氢钠,反应的离子方程式为______________
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀指示到达滴定终点当溶液中Cl恰好完全沉淀(浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为_______mol·L-1,此时溶液中c(CrO42-)等于_______mol·L-1.(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)
【答案】增大 增大 CH3COO- B C Cl2+HCO3- =CO2↑+Cl-+HClO 2.0×10-5 5.0×10-3
【解析】
(1)由表格数据可知,升高温度,平衡常数减小,说明平衡逆向移动,因此该反应正向为放热反应; 根据温度、浓度对平衡影响进行混合气体的平均相对分子质量、气体的密度变化情况分析;
(2)①上述盐均为强碱弱酸盐,相同浓度的盐溶液的pH越小,其水解能力越弱;
②对应酸的酸性越弱,其阴离子越易水解,其盐溶液碱性越强,在稀释时酸性越弱pH变化越小;
③酸性强的制备酸性弱的,根据强酸制取弱酸判断;
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,和盐酸反应生成二氧化碳气体,促进平衡正向进行;
(3)当溶液中Cl完全沉淀时,即c(Cl)=1.0×105mol/L,依据Ksp(AgCl)计算得到c(Ag+),此时溶液中 。
。
(1)由表格数据可知,升高温度,平衡常数减小,说明平衡逆向移动,因此该反应正向为放热反应,降低温度,平衡将正向移动,CO2增加的物质的量等于CO减小的物质的量,因此混合气体的平均相对分子质量增大;充入氮气,该反应平衡不发生移动,但气体总质量增加,气体体积不变,因此混合气体的密度增大;
(2)①上述盐均为强碱弱酸盐,相同浓度的盐溶液的pH越小,其水解能力越弱,因此水解能力最弱的是CH3COO-;
②对应酸的酸性越弱,其阴离子越易水解,其盐溶液碱性越强,所以pH最小的酸性最强,所以CH3COOH酸性最强,在稀释时酸性越弱pH变化越小,pH变化最小的是HCN;
③A.CH3COOH的酸性大于碳酸,则CH3COOH+Na2CO3=NaHCO3+CH3COONa能够发生,故A不符合题意;
B.CH3COOH的酸性大于HCN,则CH3COOH+NaCN=CH3COONa+HCN能够发生,故B不符合题意;
C.HClO的酸性大于碳酸氢根离子,则CO2与NaClO生成碳酸氢根离子,不能生成碳酸钠,所以CO2+H2O+2NaClO=Na2CO3+2HClO不能发生,故C符合题意;
故答案为:C;
④HClO和碳酸钠不反应,盐酸和碳酸钠反应生成二氧化碳,所以导致氯水中HClO浓度增大,离子方程式为:![]() ;
;
(3)当溶液中Cl完全沉淀时,即c(Cl)=1.0×105mol/L,依据Ksp(AgCl)=2.0×1010,计算得到c(Ag+)= ;此时溶液中
;此时溶液中 。
。

 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案【题目】在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法不正确的是( )
A.实验①中,若5min未测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速v(N)=1.0×10-3mol·L-1·min-1
B.实验②中,达到平衡时,Y的转化率为20%
C.实验③中,该反应的平衡常数K=1.0
D.实验④中,达到平衡时, b>0.060