题目内容
【题目】运用现代科技从苦艾精油中分离出多种化合物,其中四种的结构如下:
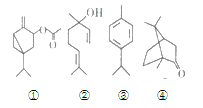
下列说法不正确的是( )
A.②③分子中所有碳原子不可能处于同一平面内
B.②④互为同分异构体
C.④的一氯代物有6种
D.①②③均能使酸性高锰酸钾溶液褪色
【答案】B
【解析】
A. ②③分子中所有碳原子不可能在同一个平面内,A项正确,不符合题意;
B. ②④的分子式分别为C10H180、C10H16O,二者分子式不同,不属于同分异构体,B项错误,符合题意;
C. ④有6种等效H原子,其一氯代物有6种,C项正确,不符合题意;
D. ①②中均含有碳碳双键,均可被酸性高锰酸钾溶液氧化,③的苯环上含有甲基、异丙基,能够被酸性高锰酸钾溶液氧化,D项正确,不符合题意;
答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g)Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如表
T/K | 938 | 1100 |
K | 0.68 | 0.40 |
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态、若降低温度,混合气体的平均相对分子质量__________________;充入氮气,混合气体的密度__________________(填“增大”“减小”或“不变”)。
(2)常温下,浓度均为0.1mol·的下列五种溶液的pH如下表
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①上述盐溶液中的阴离子,水解能力最弱的是__________________。
②根据表中数据判断,浓度均为0.01mol·L-1的下列四种物质的溶液分别稀释100倍,pH变化最小的是_______(填编号)
A. HClO B. HCN C.H2CO3 D. CH3COOH
③据上表数据,请你判断下列反应不能成立的是_______(填编号)
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
④要增大氯水中HClO的浓度,可向氯水中加入碳酸氢钠,反应的离子方程式为______________
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀指示到达滴定终点当溶液中Cl恰好完全沉淀(浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为_______mol·L-1,此时溶液中c(CrO42-)等于_______mol·L-1.(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)
【题目】氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂。
回答下列问题:
(1)①一氯胺(NH2Cl)的电子式为__________。
②工业上可利用反应Cl2(g)+NH3(g)=NH2Cl(l)+HCl(g)制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的链能相同),则该反应的△H=______________。
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
③一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生水解,生成具有强烈杀菌作用的物质,该反应的化学方程式为_________________。
(2)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)![]() NHCl2(g)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol C12和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NHCl2(g)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol C12和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 |
n(Cl2) (乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①甲容器中,0~40 min内用NH3的浓度变化表示的平均反应速率v(NH3)=______________。
②该反应的△H________0(填“>”或“<”) ,理由是____________________。
③对该反应,下列说法正确的是______________(填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内C12和NH3物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后,其他条件不变,在原容器中充入一定量氦气,Cl2的转化率增大
D.反应达到平衡后,其他条件不变,加入一定量的NHCl2,平衡向逆反应方向移动
(3)在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),测得平衡时Cl
NHCl2(l)+2HCl(g),测得平衡时Cl
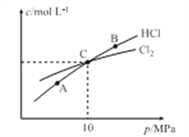
①A、B、C三点中Cl2转化率最高的是______点(填“A”“B”或“C”)。
②计算C点时该反应的压强平衡常数Kp(C)=_______(Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)