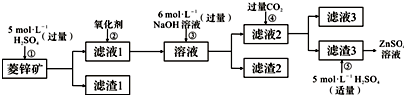
题目内容
13.“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,有关说法正确的是( )
| A. | 转移0.1mol电子时,a电极产生1.12LH2 | |
| B. | b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH- | |
| C. | c电极上进行还原反应,B电池中的H+可以通过隔膜进入A池 | |
| D. | d电极上发生的电极反应是:O2+4H++4e-=2H2O |
分析 依据图示ab电极是电解池的电极,由电源判断a为阴极产生的气体是氢气,b为阳极产生的气体是氧气;cd电极是原电池的正负极,c是正极,d是负极;电解池中的电极反应为:b电极为阳极失电子发生氧化反应:4OH--4e-=2H2O+O2↑;a电极为阴极得到电子发生还原反应:4H++4e-=2H2↑;
原电池中是酸性溶液,电极反应为:d为负极失电子发生氧化反应:2H2-4e-=4H+;c电极为正极得到电子发生还原反应:O2+4H++4e-=2H2O;
结合电极上的电子守恒分析计算.
解答 解:电解池中的电极反应为:b电极为阳极失电子发生氧化反应:4OH--4e-=2H2O+O2↑;a电极为阴极得到电子发生还原反应:4H++4e-=2H2↑;
原电池中是酸性溶液,电极反应为:d为负极失电子发生氧化反应:2H2-4e-=4H+;c电极为正极得到电子发生还原反应:O2+4H++4e-=2H2O;
A、阳极电极反应计算,当有0.1 mol电子转移时,a电极产生标况下1.12LH2,未指明标况,不一定是1.12LH2,故A错误;
B、b电极上发生的电极反应是4OH--4e-=2H2O+O2↑,故B错误;
C、c电极上进行还原反应,B池中的H+可以通过隔膜进入A池,故C正确;
D、d电极上发生的电极反应是:2H2-4e-=4H+,故D错误;
故选C.
点评 本题考查了化学电源新型电池,主要考查原电池和电解池的工作原理,电极判断,电极反应,关键是原电池中电解质溶液是酸性环境,注意电极书写.

练习册系列答案
相关题目
2.如图是四种常见有机物的比例模型示意图.下列说法正确的是( )
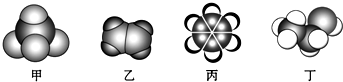

| A. | 甲能使酸性高锰酸钾溶液褪色 | |
| B. | 乙可与酸性高锰酸钾发生加成反应 | |
| C. | 丙中的碳碳键是介于碳碳单键和碳碳双键之间的独特的键 | |
| D. | 丁可与乙酸发生中和反应 |
1.“北大富硒康”中含有微量元素硒(Se),对人体有保健作用.已知硒为第4周期ⅥA族元素,根据它在周期表中的位置推测硒不可能具有的性质为( )
| A. | 硒化氢不稳定 | |
| B. | 硒化氢的水溶液显弱酸性 | |
| C. | 得电子能力强于硫 | |
| D. | 其最高价氧化物的水化物酸性强于砷弱于溴 |
18.有一混合溶液中含有以下离子中的若干:K+、NH4+、Cl-、HCO3-、SO32-、SO42-、Ag+.现取等体积的两份溶液进行如下实验:
(1)第一份加入足量的NaOH溶液,无沉淀;加热,收集到标准状况下的气体336mL.
(2)第二份加入足量的用盐酸酸化的BaCl2溶液,产生2.33g白色沉淀,同时收集到标准状况下的气体336mL,该气体能使品红溶液褪色.
根据上述实验,下列推断正确的是( )
(1)第一份加入足量的NaOH溶液,无沉淀;加热,收集到标准状况下的气体336mL.
(2)第二份加入足量的用盐酸酸化的BaCl2溶液,产生2.33g白色沉淀,同时收集到标准状况下的气体336mL,该气体能使品红溶液褪色.
根据上述实验,下列推断正确的是( )
| A. | K+一定存在 | |
| B. | Ag+和Cl-一定不存在 | |
| C. | HCO3-一定不存在 | |
| D. | 混合溶液中一定有0.015 mol SO32- |
2.下列有关实验的说法正确的是( )
| A. | CH2=CH-CHO能使酸性高锰酸钾溶液褪色,证明该分子中一定含有碳碳双键 | |
| B. | 现向K2Cr2O7溶液中加入少量氢氧化钠,溶液变为黄色,证明溶液中存在着平衡:Cr2O72-+H2O?2CrO42-+2H+ | |
| C. | 用相互滴加的方法不能鉴别NaCl、AlCl3、Na2CO3、NaHSO4四种无色溶液 | |
| D. | SO2通入Ba(NO3)2溶液中出现白色沉淀,证明BaSO3不溶于水 |
3.李克强总理在全国人大会议上提出“要大力抓好节能降耗、保护环境”,下列举措与这一主题不相符的是( )
| A. | 用“绿色化学”工艺,使原料完全转化为目标产物 | |
| B. | 开发新能源,减少化石能源的使用,减少污染 | |
| C. | 开发新型电池,推广废旧电池的回收、处理经验 | |
| D. | 大量使用农药化肥,减少病虫害,提高粮食产量 |