题目内容
11.某氮肥厂氨氮废水中的氮元素多以NH4+和NH3•H2O的形式存在,该废水的处理如图1:(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收.
(2)过程Ⅱ:在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-.两步反应的能量变化示意图如图2:
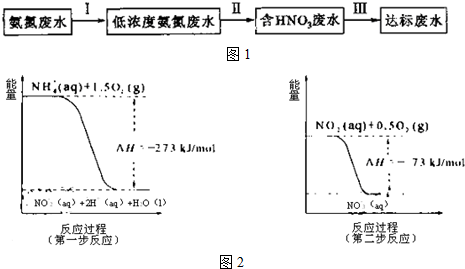
在过程Ⅰ中 ①用离子方程式表示加NaOH溶液的作用:NH4++OH-═NH3•H2O.
②用化学平衡原理解释通空气的目的:空气可以将生成的氨气带走,使化学平衡向正反应方向移动,促进了氨水电离.
③写出1mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式:NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol.
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2.若该反应消耗32gCH3OH转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是5:6.
分析 (2)①铵根能和强碱反应生成一水合氨;②减少生成物,可以使化学平衡向正反应方向移动;③结合图象根据盖斯定律来计算反应的焓变;
(3)根据消耗甲醇的量和转移电子的量来书写方程式,并确定氧化剂和还原剂的量的多少.
解答 解:(2)①铵盐能和强碱反应,实质是:NH4++OH-═NH3•H2O,
故答案为:NH4++OH-═NH3•H2O;
②氨水电离是可逆反应,将生成的氨气带走,即减少生成物,可以使化学平衡向正反应方向移动,即更多的生成氨气,因而促进了氨水电离,
故答案为:空气可以将生成的氨气带走,使化学平衡向正反应方向移动,促进了氨水电离;
③第一步的热化学方程式为NH4+(aq)+1.5O2(g)═NO2-(aq)+2H+(aq)+H2O(l),△H=-273KJ/mol,第二步的热化学方程式为:NO2-(aq)+0.5O2(g)═NO3-(aq),△H=-73KJ/mol,根据盖斯定律则NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol,
故答案为:NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol;
(3)消耗32g(1mol)CH3OH转移6mol电子,由CH3OH中碳原子的化合价升高6,所以反应后碳的化合价为+4,产物为CO2,根据质量守恒和化合价升降总数相等得:5CH3OH+6HNO3═5CO2+3N2+13H2O,反应中氧化剂是硝酸,还原剂是甲醇,参加反应的还原剂和氧化剂的物质的量之比是5:6,
故答案为:5:6.
点评 本题是一道有关化学平衡和热化学方程式的题目,综合性较强,题目难度中等,注意平时知识的积累和灵活应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列物质一定属于同系物的是( )


| A. | ⑦⑧ | B. | ⑤⑦ | C. | ①②③ | D. | ④⑥⑧ |
19.下列离子方程式书写正确的是( )
| A. | 氧化铜与盐酸反应 O2-+2H+═H2O | |
| B. | 碳酸氢钠溶于盐酸:HCO3-+H+=H2O+CO2↑ | |
| C. | 硫酸氢钠溶液与NaOH溶液混合:HSO4-+OH-=H2O+SO42- | |
| D. | 石灰石溶于硝酸:CO32-+2H+=H2O+CO2↑ |
6.设阿伏加德罗常数的值为NA,则下列说法不正确的是( )
| A. | 1mol Na参加氧化还原反应时电子转移NA | |
| B. | 3.2g SO2与2.3g NO2所含有的氧原子数相等 | |
| C. | 标准状况下,2.24L SO3含有的O原子数为0.3NA | |
| D. | 1L 0.1mol/LMgCl2溶液中Cl-离子数为0.2NA |
16.下列物质的分类组合正确的是( )
| A | B | C | D | |
| 化合物 | HCl | NaOH | Cu2(OH)2SO4 | FeSO4•7H2O |
| 氧化物 | H2O | Na2O | CO | Fe3O4 |
| 电解质 | 浓盐酸 | 纯碱 | 胆矾溶液 | 铁 |
| A. | A | B. | B | C. | C | D. | D |
3.设NA为阿伏加德罗常数,下列说法中正确的是( )
| A. | 1000mL0.1mol/L 的NaCl溶液中,Na+与Cl-离子总数为0.2NA | |
| B. | 2NA个二氧化碳分子的质量为44g | |
| C. | NA个氢气分子所占的体积为22.4L | |
| D. | 17g氨气中所含原子数为NA |
20.下列实验现象与对应结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 常温下将Cu片放入浓H2SO4中 | 生成刺激性气味气体 | Cu与浓H2SO4反应生成SO2 |
| B | Al2(SO4)3溶液中滴加过量氨水 | 生成白色胶状物质 | Al(OH)3不溶于氨水 |
| C | 向某溶液中加入新制氯水,再向溶液中加入KSCN溶液 | 溶液变红色 | 该溶液中含有Fe2+ |
| D | 向某溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 该溶液中存在I- |
| A. | A | B. | B | C. | C | D. | D |
1.将反应Mn2++Bi3-+H+→MnO4-+Bi3++H2O配平后,H+的化学计量数为( )
| A. | 8 | B. | 10 | C. | 14 | D. | 30 |