题目内容
8.容量瓶上不具有的标识是( )| A. | 零刻度 | B. | 温度 | C. | 规格(体积) | D. | 刻度线 |
分析 根据容量瓶的使用特点来回答,容量瓶是用来配制一定体积、一定物质的量浓度溶液的定量仪器,对溶液的体积精确度要求较高,只能在常温下使用.
解答 解:容量瓶是用来配制一定体积、一定物质的量浓度溶液的定量仪器,实验室常见规格有50ml、100ml、150ml、200ml、500ml等,容量瓶上标有刻度线、并标有容量,容量瓶对溶液的体积精确度要求较高,只能在常温下使用,瓶上标有使用温度,一般为25°C.
故选A.
点评 本题考查常见仪器的使用,注意容量瓶的使用注意事项,题目难度不大,要注意积累各种化学实验仪器的使用方法.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
18. 在容积均为500mL的Ⅰ,Ⅱ,Ⅲ三个密闭容器(容器体积恒定不变)中分别充入1molN2和2.5molH2,三个容器的反应温度分别为T1,T2,T3,且恒定不变.在其他条件相同的情况下发生反应:N2+3H2?2NH3△H<0.实验测得反应均进行到t min时N2的体积分数如图所示.下列说法正确的是( )
在容积均为500mL的Ⅰ,Ⅱ,Ⅲ三个密闭容器(容器体积恒定不变)中分别充入1molN2和2.5molH2,三个容器的反应温度分别为T1,T2,T3,且恒定不变.在其他条件相同的情况下发生反应:N2+3H2?2NH3△H<0.实验测得反应均进行到t min时N2的体积分数如图所示.下列说法正确的是( )
 在容积均为500mL的Ⅰ,Ⅱ,Ⅲ三个密闭容器(容器体积恒定不变)中分别充入1molN2和2.5molH2,三个容器的反应温度分别为T1,T2,T3,且恒定不变.在其他条件相同的情况下发生反应:N2+3H2?2NH3△H<0.实验测得反应均进行到t min时N2的体积分数如图所示.下列说法正确的是( )
在容积均为500mL的Ⅰ,Ⅱ,Ⅲ三个密闭容器(容器体积恒定不变)中分别充入1molN2和2.5molH2,三个容器的反应温度分别为T1,T2,T3,且恒定不变.在其他条件相同的情况下发生反应:N2+3H2?2NH3△H<0.实验测得反应均进行到t min时N2的体积分数如图所示.下列说法正确的是( )| A. | 当v(H2)=3v(N2)时.可以说明三个容器中的反应达平衡状态 | |
| B. | 在t min时,一定达化学平衡状态的是III | |
| C. | 在t min时测得Ⅲ中c(N2)=1mol•L-1,若再向Ⅲ中充人1.5molN2和1molNH3,H2的转化率增大 | |
| D. | 三个容器中的反应均达到平衡后.氨气的质量分数Ⅰ>Ⅱ>Ⅲ |
19.不能用离子方程式:SO42-+Ba2+═BaSO4↓来表示的该反应的化学方程式是( )
| A. | 硝酸钡溶液与稀硫酸 | B. | 稀硫酸与氯化钡溶液反应 | ||
| C. | 碳酸钡与稀硫酸 | D. | 氯化钡溶液与硫酸钠溶液 |
16.在粗盐提纯实验中,要溶解10g粗盐,所需要量取水的体积最佳为(常温下氯化钠的溶解度为36g/100g水)( )
| A. | 100mL | B. | 40mL | C. | 50mL | D. | 30mL |
13.工业上用CO生产甲醇的反应为CO(g)+2H2(g)?CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积固定为2L的密闭容器中加入4mol H2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图.下列叙述错误的是( )


| A. | CO和H2合成CH3OH的反应:△H<0,△S<0 | |
| B. | 保持温度不变,再充入1molCO和2molH2,反应达到新平衡时$\frac{n(CHOH)}{n(CO)}$减小 | |
| C. | 图1中曲线b可表示使用了催化剂的能量变化情况 | |
| D. | 图3中曲线可表示在不同压强P1、P2(P1<P2)条件下甲醇百分含量随温度变化的情况 |
20.下列实验操作中正确的是( )
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏时,温度计水银球靠近蒸馏烧瓶的支管口处,且冷却水从冷凝管的上口通入下口流出 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 向1 mol•L-1氯化铁溶液中加入少量的NaOH溶液制取氢氧化铁胶体 |
17.在一定条件下,下列可逆反应达到化学平衡:H2(g)+I2(g)(紫黑色)?2HI(g)△H<0,要使混合气体的紫黑色加深:采取的方法是( )
| A. | 降低温度 | B. | 升高温度 | C. | 减小体积 | D. | 增大体积 |
18.湖南省常德市石门县鹤山村用土法炼砒霜导致地下水砷污染严重,157人中毒死亡.关于砷(33As)的说法不正确的是( )
| A. | 砷的氢化物和磷的氢化物的稳定性为PH3<AsH3 | |
| B. | 砷原子核内有33个质子 | |
| C. | 砷是第四周期第VA族 | |
| D. | 砷的最高价氧化物对应的水化物的化学式是H3AsO4 |
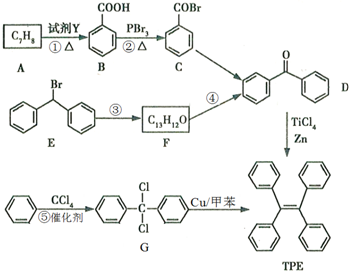
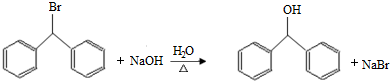 .
.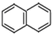 )的一元取代物;②能发生银镜反应.满足条件的W的结构简式共有4种(不考虑顺反异构).
)的一元取代物;②能发生银镜反应.满足条件的W的结构简式共有4种(不考虑顺反异构).