题目内容
13.工业上用CO生产甲醇的反应为CO(g)+2H2(g)?CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积固定为2L的密闭容器中加入4mol H2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图.下列叙述错误的是( )
| A. | CO和H2合成CH3OH的反应:△H<0,△S<0 | |
| B. | 保持温度不变,再充入1molCO和2molH2,反应达到新平衡时n(CHOH)n(CO)n(CHOH)n(CO)减小 | |
| C. | 图1中曲线b可表示使用了催化剂的能量变化情况 | |
| D. | 图3中曲线可表示在不同压强P1、P2(P1<P2)条件下甲醇百分含量随温度变化的情况 |
分析 A.该反应是放热反应,焓变小于0,反应前后气体体积减小,气体体积减小则熵减;
B.再充入1molCO和2molH2,体积不变,则压强增大,平衡正向移动;
C.使用催化剂能改变反应途径,但不影响平衡移动;
D.根据温度和压强对化学平衡的影响分析.
解答 解:A.该反应是一个反应前后气体体积减小的放热反应,所以△H<0,△S<0,故A正确;
B.再充入1molCO和2molH2,体积不变,则压强增大,平衡正向移动,再次达到平衡时n(CH3OH)n(CO)n(CH3OH)n(CO)会增大,故B错误;
C.使用催化剂能降低反应需要的活化能从而改变反应途径,但不影响平衡移动,所以放出的能量不变,故C正确;
D.该反应是一个反应前后气体体积减小的放热反应,升高温度平衡向逆反应方向移动,则甲醇的含量减少,增大压强平衡向正反应方向移动,乙醇的含量增大,故D正确;
故选B.
点评 本题考查化学平衡及能量变化,学生应根据图象来分析解决问题,图象中的信息是解答本题的关键.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
4.下列物质中,属于电解质的是( )
| A. | 氯化钠溶液 | B. | 二氧化碳 | C. | 氢氧化钠固体 | D. | 铁 |
1.在空气中,有下列反应发生:①N2+O2═2NO;②2NO+O2═2NO2;③3NO2+H2O═2HNO3+NO;④2SO2+O2═2SO3;⑤SO3+H2O═H2SO4;⑥SO2+H2O═H2SO3;⑦3O2═2O3.其中属于氧化还原反应的是( )
| A. | ①②③④ | B. | ①②③④⑦ | C. | ①②④⑦ | D. | ①②③④⑤⑥⑦ |
8.容量瓶上不具有的标识是( )
| A. | 零刻度 | B. | 温度 | C. | 规格(体积) | D. | 刻度线 |
2.砹(At)是卤素中核电荷数最大的元素,下列推测中错误的是( )
| A. | 砹为有色固体 | B. | AgAt不溶于水 | ||
| C. | HAt 很稳定 | D. | 砹单质熔沸点比碘单质熔沸点高 |
3.居里夫人因对Ra(镭)元素的研究两次获得诺贝尔奖,镭(Ra)的一种同位素是2268822688Ra,有关该同位素的说法正确的是( )
| A. | 质子数为226 | B. | 电子数为138 | C. | 中子数为138 | D. | 质量数为314 |
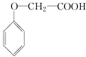 发生化学反应的产物.
发生化学反应的产物. 、
、 等.
等.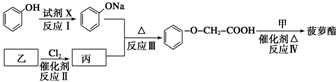
 .
.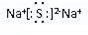 ,所含化学键类型离子键;
,所含化学键类型离子键;