题目内容
19.不能用离子方程式:SO42-+Ba2+═BaSO4↓来表示的该反应的化学方程式是( )| A. | 硝酸钡溶液与稀硫酸 | B. | 稀硫酸与氯化钡溶液反应 | ||
| C. | 碳酸钡与稀硫酸 | D. | 氯化钡溶液与硫酸钠溶液 |
分析 离子方程式SO42-+Ba2+═BaSO4↓表示硫酸或可溶性硫酸盐与可溶性钡离子的盐反应只生成硫酸钡沉淀和可溶性盐的反应,即:生成产物中除了硫酸钡沉淀,不含有气体、其它难溶物、弱电解质等,据此进行判断.
解答 解:A.硫酸钡与稀硫酸反应生成硫酸钡沉淀,反应的离子方程式为:SO42-+Ba2+═BaSO4↓,故A错误;
B.稀硫酸与氯化钡溶液反应生成硫酸钡和氯化氢,反应的离子方程式为:SO42-+Ba2+═BaSO4↓,故B错误;
C.碳酸钡为难溶物,离子方程式中不能拆开,不能用SO42-+Ba2+═BaSO4↓来表示,故C正确;
D.氯化钡溶液与硫酸钠溶液反应生成硫酸钡沉淀和氯化钠,反应的离子方程式为:SO42-+Ba2+═BaSO4↓,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,题目难度中等,明确离子方程式的书写原则为解答关键,注意掌握离子方程式表示意义,试题培养了学生的分析、理解能力及规范答题能力.

练习册系列答案
相关题目
10.根据反应式:2Fe3++2I-═2Fe2++I2,Br2+2Fe2+═2Br-+2Fe3+,可以判断微粒的氧化性从强到弱的顺序是( )
| A. | Fe3+、Br2、I2 | B. | I2、Br2、Fe3+ | C. | Br2、Fe3+、I2 | D. | Br2、I2、Fe3+ |
4.下列物质中,属于电解质的是( )
| A. | 氯化钠溶液 | B. | 二氧化碳 | C. | 氢氧化钠固体 | D. | 铁 |
11.下列溶液中的Cl-浓度与50mL 1mol•L-1 MgCl2溶液中的Cl-浓度相等的是( )
| A. | 50mL 1 mol•L-1NaCl溶液 | B. | 100mL 2 mol•L-1 AlCl3溶液 | ||
| C. | 100mL 1 mol•L-1 NH4Cl溶液 | D. | 150mL 2 mol•L-1 KCl溶液 |
8.容量瓶上不具有的标识是( )
| A. | 零刻度 | B. | 温度 | C. | 规格(体积) | D. | 刻度线 |
9.已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH?CH3COO−+H+,要使溶液中c(H+)值增大,可以采取的措施是( )
| A. | 加少量烧碱溶液 | B. | 加蒸馏水 | ||
| C. | 加少量醋酸钠固体 | D. | 升高温度 |
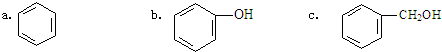
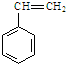 )是一种重要的有机化工原料.
)是一种重要的有机化工原料.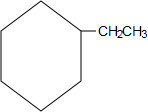 .
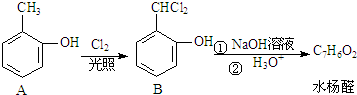
.
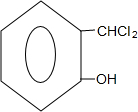 +2NaOH
+2NaOH +2NaCl+H2O.
+2NaCl+H2O.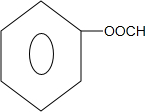 、
、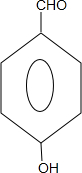 .
.
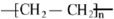 ,反应类型为加聚反应.
,反应类型为加聚反应.
 ;
; (只要求写出其中一种同分异构体)
(只要求写出其中一种同分异构体) 经过反应也可制得化合物IV,则R在NaOH醇溶液中反应的化学方程式为
经过反应也可制得化合物IV,则R在NaOH醇溶液中反应的化学方程式为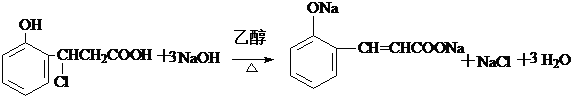 或
或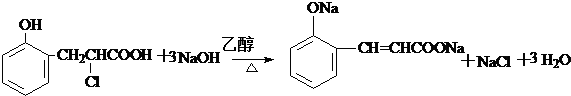 .
.