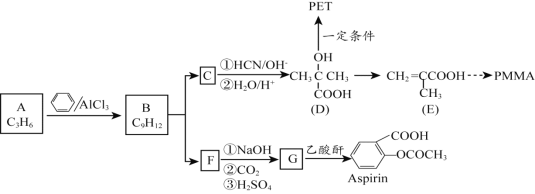
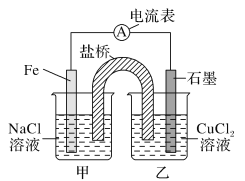
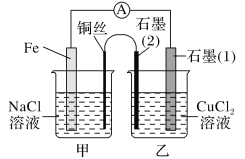
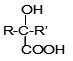题目内容
【题目】下表记录了t℃时的4份相同的硫酸铜溶液中加入无水硫酸铜的质量以及析出的硫酸 铜晶体(CuSO4·5H2O)的质量(温度保持不变)的实验数椐:
硫酸铜溶液 | ① | ② | ③ | ④ |
加入的无水硫酸铜(g) | 3.00 | 5.50 | 8.50 | 10.00 |
析出的硫酸铜晶体(g) | 1.00 | 5.50 | 10.90 | 13.60 |
当加入6.20g无水硫酸铜时,析出硫酸铜晶体的质量(g)为
A.7.70B.6.76C.5.85D.9.00
【答案】B
【解析】
根据图表可看出无水硫酸铜的质量每增加0.5g析出硫酸铜晶体的质量就增加0.9g,可求出增加0.7g无水硫酸铜析出硫酸铜晶体的质量;设0.7g无水硫酸铜可析出硫酸铜晶体的质量为x,![]() =
=![]() ,解得x=1.26;
,解得x=1.26;
6.2g无水硫酸铜时,析出硫酸铜晶体的质量为:5.5g+1.26g=6.76g;
答案选B。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】滴定实验是化学学科中重要的定量实验。请回答下列问题:
Ⅰ.酸碱中和滴定——已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下实验:
①称量1.00 g样品溶于水,配成250 mL溶液;
②准确量取25.00 mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用0.10 mol/L的盐酸标准液滴定三次,每次消耗盐酸的体积记录如下:
滴定序号 | 待测液体积mL | 所消耗盐酸标准液的体积/mL | |
滴定前读数 | 滴定后读数 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 6.00 | 26.00 |
3 | 25.00 | 1.10 | 21.00 |
(1)用__________滴定管(填“酸式”或“碱式”)盛装0.10 mol/L的盐酸标准液
(2)试样中NaOH的质量分数为__________
(3)若出现下列情况,测定结果偏高的是________
A.滴定前用蒸馏水冲洗锥形瓶
B.在振荡锥形瓶时不慎将瓶内溶液溅出
C.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
D.酸式滴定管滴至终点时,俯视读数
E.酸式滴定管用蒸馏水洗后,未用标准液润洗
Ⅱ.氧化还原滴定
(4)取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1 mol·L-1的高锰酸钾溶液滴定,发生的反应为2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O滴定时,KMnO4溶液应装在酸式滴定管中,滴定终点时现象是__________
(5)用0.01 mol/L的I2标准溶液滴定未知浓度的Na2S2O3溶液,选用的指示剂是__________