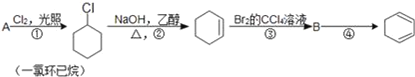
题目内容
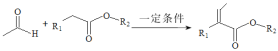
【题目】图表示反应M (g) + N (g)![]() 2R(g)过程中能量变化,下列有关叙述正确的是
2R(g)过程中能量变化,下列有关叙述正确的是

A.由图可知,2molR的能量高于1molM和1molN的能量和
B.曲线B代表使用了催化剂,反应速率加快,M的转化率: 曲线B >曲线A
C.1molM和1molN的总键能高于2molR的总键能
D.对反应2R(g) ![]() M (g) + N (g)使用催化剂没有意义
M (g) + N (g)使用催化剂没有意义
【答案】C
【解析】
A.图象中反应物能量低于生成物能量,故反应是吸热反应,生成物的总能量高于反应物的总能量,即2molR(g)的能量高于1molM(g)和1molN(g)的能量和,但A选项中未注明物质的聚集状态,无法比较,选项A错误;
B.催化剂改变化学反应速率是降低了反应的活化能,改变反应的路径,曲线B代表使用了催化剂,反应速率加快,但M的转化率:曲线B=曲线A,选项B错误;
C.图象中反应物能量低于生成物能量,故反应是吸热反应,键能是指断开键所需的能量,1molM和1molN的总键能高于2molR的总键能,选项C正确;
D.图象分析使用催化剂能加快化学反应速率,选项D错误;
答案选C。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案【题目】下表记录了t℃时的4份相同的硫酸铜溶液中加入无水硫酸铜的质量以及析出的硫酸 铜晶体(CuSO4·5H2O)的质量(温度保持不变)的实验数椐:
硫酸铜溶液 | ① | ② | ③ | ④ |
加入的无水硫酸铜(g) | 3.00 | 5.50 | 8.50 | 10.00 |
析出的硫酸铜晶体(g) | 1.00 | 5.50 | 10.90 | 13.60 |
当加入6.20g无水硫酸铜时,析出硫酸铜晶体的质量(g)为
A.7.70B.6.76C.5.85D.9.00
【题目】氮是一种重要的元素,可用来合成NH3与 HNO3等一系列重要化工产品。
(1)在标准状况下,1体积水溶解700体积氨气,所得溶液的密度为0.9g/mL,则该氨水的物质的量浓度是_______(小数点后保留一位)。
(2)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的。其主要反应是:
①2C + O2 → 2CO ②C + H2O(g) → CO + H2 ③CO + H2O(g) → CO2 + H2
某次生产中将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4:1,下同)混合反应,所得气体产物经分析,组成如下表:
气体 | CO | N2 | CO2 | H2 | O2 |
体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
则计算参加反应的H2O(g)和氧气的体积比V(H2O)/V(氧气)=__________上表中x=________m3,实际消耗了___________ kg焦炭。
(3)工业生产硝酸时尾气必须充分处理以避免环境污染,常用NaOH溶液吸收,吸收时发生反应:
①2NO2 + 2NaOH→NaNO3 + NaNO2 + H2O
②NO + NO2 + 2NaOH→2NaNO2 + H2O
现将22.4升(标准状况)NOx(只含NO、NO2,忽略其它成分)气体缓缓通入足量NaOH溶液中,充分反应,气体全部被吸收。则反应中产生NaNO3和NaNO2各多少克?(用含x的代数式表示)____________________