题目内容
【题目】羟氨(NH2OH)是一种还原剂,和联氨一样是一种弱碱,不稳定,室温下吸收水汽迅速分解。回答下列问题:
(1)请写出羟氨的电子式___。
(2)利用KMnO4标准溶液定量间接测定羟氨的纯度。测定步骤如下:
①溶液配制:称取5.0g某羟氨样品,溶解在______酸中后加适量蒸馏水,将其全部转移至100mL的______中,加蒸馏水至_______。
②取20.00mL的羟氨酸性溶液与足量硫酸铁在煮沸条件下反应:2NH2OH2++4Fe3+=N2O↑+4Fe2++H2O+6H+,生成的Fe2+用0.4000 mol·L-1的酸性KMnO4溶液滴定,滴定达到终点的现象是____________。请写出Fe2+与酸性KMnO4溶液反应的离子方程式_____________。重复滴定3次,每次消耗酸性高锰酸钾标准溶液的体积如表所示:
![]()
计算试样的纯度____%。
(3)下列操作导致误差偏高的有______(填编号)。
a 滴定前滴定管尖嘴处有气泡,滴定后消失
b 滴定管未经润洗盛装KMnO4溶液
c 羟氨称量时,时间过长和溶解时没有及时用酸酸化
d KMnO4溶液起始读数仰视,终点正常读数
【答案】![]() 硫酸 容量瓶 刻度线 当最后一滴滴入时,锥形瓶中溶液的颜色由无色变为紫红色,且半分钟不褪色 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 66 ab
硫酸 容量瓶 刻度线 当最后一滴滴入时,锥形瓶中溶液的颜色由无色变为紫红色,且半分钟不褪色 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 66 ab
【解析】
(1)根据羟氨化学式写出其电子式;
(2)①羟氨应溶解在H2SO4中,因为HCl中的Cl会被MnO4-氧化;
②用酸性KMnO4溶液滴定达到终点的现象是当最后一滴滴入时,锥形瓶中溶液的颜色由无色变为紫红色,且半分钟不褪色;根据氧化还原反应的规律写出Fe2+与酸性KMnO4溶液反应的离子方程式,根据物质的量的关系计算式样纯度;
(3)根据氧化还原滴定的相关操作分析实验误差。
(1)根据羟氨化学式NH2OH可知其电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)①羟氨应溶解在H2SO4中,因为HCl中的Cl会被MnO4-氧化,将其全部转移至100mL的容量瓶中,加蒸馏水至刻度线,故答案为:硫酸;容量瓶;刻度线;
②用酸性KMnO4溶液滴定达到终点的现象是当最后一滴滴入时,锥形瓶中溶液的颜色由无色变为紫红色,且半分钟不褪色;根据氧化还原反应的规律写出Fe2+与酸性KMnO4溶液反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;由消耗高锰酸钾体积表可知,第一次误差过大,舍去,V(平均)=![]() =20.00mL;
=20.00mL;
设滴定时NH2OH2+的物质的量为xmol,依据离子方程式可得关系式:
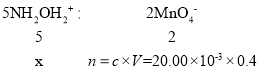
解得x=0.02
因总量为100mL,所以n(NH2OH2+)=0.02×5=0.1mol
m=n![]() M=0.1×33g/mol=3.3g
M=0.1×33g/mol=3.3g
w=![]() =
=![]() 100%=66%
100%=66%
故答案为:当最后一滴滴入时,锥形瓶中溶液的颜色由无色变为紫红色,且半分钟不褪色;5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;66;
(3)a.滴定前滴定管尖嘴处有气泡,滴定后消失会导致V标准偏大,计算结果偏高;
b.滴定管未经润洗盛装KMnO4溶液,相当于把KMnO4溶液稀释,滴定时消耗体积增大,计算结果偏高;
c.羟氨称量时,时间过长和溶解时没有及时用酸酸化会导致羟氨被氧化,导致消耗体积偏小,计算结果偏低;
d.KMnO4溶液起始读数仰视,终点正常读数,导致消耗体积偏小,计算结果偏低;
故答案为:ab。

 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案【题目】下表记录了t℃时的4份相同的硫酸铜溶液中加入无水硫酸铜的质量以及析出的硫酸 铜晶体(CuSO4·5H2O)的质量(温度保持不变)的实验数椐:
硫酸铜溶液 | ① | ② | ③ | ④ |
加入的无水硫酸铜(g) | 3.00 | 5.50 | 8.50 | 10.00 |
析出的硫酸铜晶体(g) | 1.00 | 5.50 | 10.90 | 13.60 |
当加入6.20g无水硫酸铜时,析出硫酸铜晶体的质量(g)为
A.7.70B.6.76C.5.85D.9.00