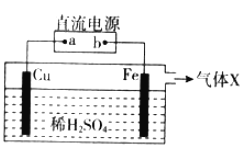
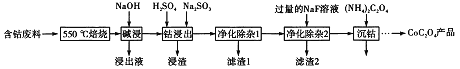
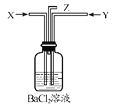
题目内容
【题目】1 mol CH4气体完全燃烧放出的热量为802 kJ,但当不完全燃烧生成CO和H2O时,放出的热量为519 kJ。如果1 mol CH4与一定量O2燃烧生成CO、CO2、H2O,并放出731.25 kJ的热量,则一定量O2的质量为( )
A. 40 g B. 56 g
C. 60 g D. 64 g
【答案】C
【解析】
1 mol CH4气体完全燃烧生成1 mol CO2和H2O(l)时,放出的热量为802 kJ , 1 mol CH4气体不完全燃烧生成1molCO和H2O(l)时,放出的热量为519 kJ,故1molCO 燃烧生成1 mol CO2,放出的热量为802-519=283 kJ,1mol甲烷不完全燃烧与完全燃烧相比,减少的热量为生成的CO燃烧放出的热量,根据减少的热量计算生成n(CO),再根据C原子守恒计算生成n(CO2),根据H原子守恒计算n(H2O),最后利用氧原子守恒计算n(O),利用m=nM计算氧原子的质量,等于消耗的氧气质量。
设CO、CO2的物质的量分别为x、y,则x+y=1mol(根据碳原子守恒),519×x+802×y=731.25,解得:x=0.25 mol y=0.75 mol,则n(O2)=![]() n(CO)+n(CO2)+
n(CO)+n(CO2)+![]() n(H2O)=
n(H2O)=![]() +0.75 mol+1 mol=1.875 mol,m(O2)= n(O2)×M(O2)=1.875 mol×32 g/mol=60 g;正确选项C。
+0.75 mol+1 mol=1.875 mol,m(O2)= n(O2)×M(O2)=1.875 mol×32 g/mol=60 g;正确选项C。

 名校课堂系列答案
名校课堂系列答案【题目】硼的无机化学问题比周期表里任何一种元素都更复杂和变化多端。
(1)基态B原子的价电子轨道表达式为___________________,第二周期第一电离能比B高的元素有_______种。
(2) B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构式为__________ (标出配位键),其中心原子的 VSEPR模型名称为________,写出[BH4]-的两种等电子体_____________________。
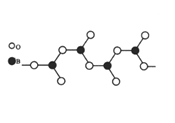
(3)图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为____________(以n表示硼原子的个数),图2表示的是一种五硼酸根离子,其中B原子的杂化方式为__________。
图1 | 图2 | 图3 |
|
|
|
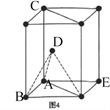
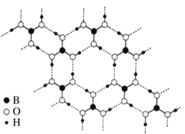
(4)硼酸晶体是片层结构,图3表示的是其中一层的结构。同一层微粒间存在的作用力有______________;同一片层划分出的一个二维晶胞(平行四边形)含有_______个H3BO3分子。
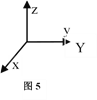
(5)1892年,化学家已用Mg还原B2O3制得硼单质。Mg属六方最密堆积,其晶胞结构如图4所示,若在晶胞中建立如图5所示的坐标系,以A为坐标原点,把晶胞的底边边长和高都视作单位1,则B、E 、C的坐标分别为B(1,0,0)、E(0,1,0)C(0,0,1),请写出D点的坐标:D:__________________