题目内容
【题目】在同体积0.3 mol·L-1的H2SO4、HCl、HNO3、CH3COOH溶液中,加入足量的Zn,下列说法中正确的是
A.硫酸中放出氢气量最多 B.醋酸中放出氢气量最多
C.盐酸中放出的氢气量最多 D.只有盐酸和硝酸中放出的氢气量相等
【答案】A
【解析】硫酸是二元强酸,产生的氢气的最多,A正确。醋酸和盐酸都是一元的,产生的氢气相同。硝酸是氧化性酸,不能生成氢气,答案选A。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】S2Cl2用作橡胶的低温硫化剂和粘结剂,向熔融的硫中通入限量氯气反应制得,进一步氯化可得SCl2。S2Cl2、SCl2的某些性质如下:
水溶性 | 密度(g/cm3) | 颜色 | 熔点 | 沸点 | |
S2Cl2 | 空气中发烟雾,遇水即水解 | 1.687 | 金黄色 | -76℃ | 138℃ |
SCl2 | 溶于水且剧烈反应 | 1.621 | 樱桃红 | -122℃ | 59℃ |
用如图所示装置制备S2Cl2,回答下列问题:
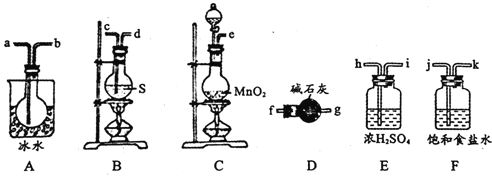
(1)已知S2Cl2分子中各原子最外层均满足8电子稳定结构,则S2Cl2的电子式为________。
(2)制取Cl2应选用的裝置是_______(填字母编号);反应的离子方程式为________。
(3)欲得到较纯净的S2Cl2,上述仪器装置的连接顺序为____(按气流方向,用小写字母表示)。
(4)仪器D的名称是_______;D中碱石灰的作用是________。
(5)为了获得更纯净的S2Cl2,需要对产品进行的操作是____________
(6)若将S2Cl2放入水中同时产生沉淀和气体,写出反应的化学方程式_________;该反应中被氧化和被还原的元素的质量之比为________________。