题目内容
【题目】S2Cl2用作橡胶的低温硫化剂和粘结剂,向熔融的硫中通入限量氯气反应制得,进一步氯化可得SCl2。S2Cl2、SCl2的某些性质如下:
水溶性 | 密度(g/cm3) | 颜色 | 熔点 | 沸点 | |
S2Cl2 | 空气中发烟雾,遇水即水解 | 1.687 | 金黄色 | -76℃ | 138℃ |
SCl2 | 溶于水且剧烈反应 | 1.621 | 樱桃红 | -122℃ | 59℃ |
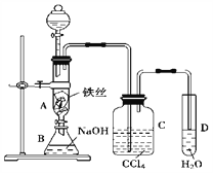
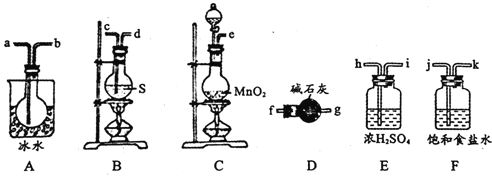
用如图所示装置制备S2Cl2,回答下列问题:
(1)已知S2Cl2分子中各原子最外层均满足8电子稳定结构,则S2Cl2的电子式为________。
(2)制取Cl2应选用的裝置是_______(填字母编号);反应的离子方程式为________。
(3)欲得到较纯净的S2Cl2,上述仪器装置的连接顺序为____(按气流方向,用小写字母表示)。
(4)仪器D的名称是_______;D中碱石灰的作用是________。
(5)为了获得更纯净的S2Cl2,需要对产品进行的操作是____________
(6)若将S2Cl2放入水中同时产生沉淀和气体,写出反应的化学方程式_________;该反应中被氧化和被还原的元素的质量之比为________________。
【答案】 ![]() C MnO2+4H++2Cl-
C MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O ejkhicdabfg 干燥管 吸收剩余的Cl2,并防止空气中的水蒸气进入A中使S2Cl2水解 分馏(或蒸馏) 2S2Cl2+2H2O=SO2↑+3S↓+4HCl 1︰3
Mn2++Cl2↑+2H2O ejkhicdabfg 干燥管 吸收剩余的Cl2,并防止空气中的水蒸气进入A中使S2Cl2水解 分馏(或蒸馏) 2S2Cl2+2H2O=SO2↑+3S↓+4HCl 1︰3
【解析】(1)S原子达到8电子稳定结构,应该形成2个共价键,Cl原子达到8电子稳定结构应该形成1个共价键,所以S2Cl2的结构式为:Cl-S-S-Cl,从而得到其电子式为:![]() 。
。
(2)实验室采用浓盐酸和二氧化锰混合加热的方式制取氯气,实验装置要选取分液漏斗、圆底烧瓶和酒精灯,所以是装置C。反应的离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(3)实验中的流程为:C装置制取氯气→F装置除去氯化氢→E装置干燥氯气→B装置制取S2Cl2→A装置收集S2Cl2→D装置尾气吸收,所以连接顺序为:ejkhicdabfg(注意装置中多为短进长出,干燥管应该是大口入小口出)。
(4)仪器D是干燥管,D中碱石灰要吸收多余的氯气,同时防止空气中的水蒸气进入装置,使S2Cl2水解。
(5)题目中给出了物质的沸点,所以得到产品后,比较好的提纯方法是蒸馏。
(6)若将S2Cl2放入水中同时产生沉淀和气体,沉淀只能是单质硫,所以硫的化合价降低,则化合价升高的只能还是硫,因此气体为二氧化硫,由上反应方程式为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl。反应中被氧化的硫有1个(生成1个SO2),被还原的硫有3个(生成3个S),所以被氧化和被还原的元素的质量之比为1:3。

 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案