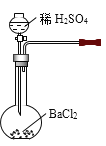
题目内容
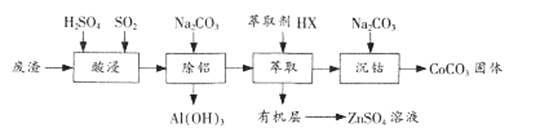
【题目】CoCO3是一种制造锂电池电极的原料。以含钴废渣(主要成分CoO、Co2O3,还含有Al2O3、 ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
①相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)

②钴元素常见的化合价为+2、+3,+2钴有较强的还原性。
③+3钴的化合物一般呈现粉红—红色。
④Ksp[Co(OH)2]=1.58×10-15 Ksp[CoCO3]=1.4×10-13
(1)“酸浸”时通人SO2的目的是 ___________。
(2)“除铝”时调节溶液pH范围为 ________,该过程中主要反应的离子方程式为___________________。
(3)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是 ___________________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是 ___________________。
(4)“沉钴”时Na2CO3溶液需缓慢滴加的原因是 ____________________。
(5)CoCO3隔绝空气灼烧可以生成Co2O3,该反应的化学方程式为____________________。
(6)在CoCO3中先加入几滴丙酮,再边振荡边逐滴加入浓氨水,沉淀逐渐由粉红色变为土黄色的含Co(NH3)6 2+的溶液,向溶液中缓缓通入一定量的氧气,溶液最终变为红色。
①加入丙酮的作用__________________________;②若在该红色溶液中滴加足量的浓盐酸生成标准状况下2.24L C12,则之前往土黄色的溶液中至少应通入标准状况下__________________________升空气(空气中氧气体积分数为0.20)。
【答案】 将Co3+还原为Co2+ 5.0~5.4 ![]() 向有机层中加入适量的硫酸溶液充分振荡,静置,分液 防止加入过快而产生Co(OH)2沉淀
向有机层中加入适量的硫酸溶液充分振荡,静置,分液 防止加入过快而产生Co(OH)2沉淀 ![]() 保护+2钴不被空气中氧气氧化 5.6升
保护+2钴不被空气中氧气氧化 5.6升
【解析】试题分析:(1)SO2具有还原性;(2)“除铝”时只能让铝离子生成氢氧化铝沉淀,Co2+、Zn2+不能沉淀;该过程中铝离子与CO32-发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;(3)根据平衡移动原理分析由有机层获取ZnSO4溶液的操作;(4)Na2CO3溶液滴加过快,溶液PH大于7.6可生成Co(OH)2沉淀;(5)CoCO3隔绝空气灼烧可以生成Co2O3,根据化合价升降规律,钴元素化合价升高,碳元素化合价要降低,同时生成CO气体;(6)①丙酮可以隔绝氧气;②根据电子守恒计算通入空气的体积;
解析:(1)SO2具有还原性,“酸浸”时通人SO2可以将Co3+还原为Co2+;(2)“除铝”时只能让铝离子生成氢氧化铝沉淀,Co2+、Zn2+不能沉淀,所以“除铝”时调节溶液pH范围为5.0~5.4;该过程中铝离子与CO32-发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,反应的离子方程式是![]() ;(3)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)
;(3)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)![]() ZnX2(有机层)+H2SO4(水层),加入硫酸可使平衡逆向移动,所以由有机层获取ZnSO4溶液的操作是向有机层中加入适量的硫酸溶液充分振荡,静置,分液;(4)“沉钴”时Na2CO3溶液需缓慢滴加的原因是防止加入过快而产生Co(OH)2沉淀;(5)CoCO3隔绝空气灼烧可以生成Co2O3,根据化合价升降规律,钴元素化合价升高,碳元素化合价要降低,同时生成CO气体,反应方程式是
ZnX2(有机层)+H2SO4(水层),加入硫酸可使平衡逆向移动,所以由有机层获取ZnSO4溶液的操作是向有机层中加入适量的硫酸溶液充分振荡,静置,分液;(4)“沉钴”时Na2CO3溶液需缓慢滴加的原因是防止加入过快而产生Co(OH)2沉淀;(5)CoCO3隔绝空气灼烧可以生成Co2O3,根据化合价升降规律,钴元素化合价升高,碳元素化合价要降低,同时生成CO气体,反应方程式是![]() ;(6)①丙酮可以隔绝氧气,保护+2钴不被空气中氧气氧化;②根据电子守恒
;(6)①丙酮可以隔绝氧气,保护+2钴不被空气中氧气氧化;②根据电子守恒![]() ,设需要空气xL,则
,设需要空气xL,则
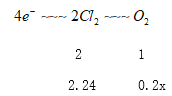
X=5.6L。