题目内容
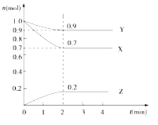
【题目】已知H2A为二元弱酸,25 ℃时,用Na2A溶液吸收H2A,且最终吸收H2A的量小于原溶液中Na2A的物质的量,其吸收液pH随![]() 变化的关系如图所示,以下说法不正确的是
变化的关系如图所示,以下说法不正确的是

A.向Na2A溶液加入H2A过程中,水电离的c(OH-)不断增大
B.NaHA溶液中:c(H+)>c(OH-)
C.H2A的第二步电离常数的数量级为10-8
D.当吸收液呈中性时:c(Na+)=2c(A2-)+c(HA-)
【答案】A
【解析】
A、向Na2A溶液加入H2A过程中,c(H+)增大,对水的电离抑制程度增大,水电离的c(OH-)不断减小,选项A不正确;
B、根据图象中吸收液的pH随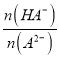 变化的关系可知,随着HA-的浓度的增大,溶液酸性增强,说明NaHA溶液显示酸性,即:c(H+)>c(OH-),选项B正确;
变化的关系可知,随着HA-的浓度的增大,溶液酸性增强,说明NaHA溶液显示酸性,即:c(H+)>c(OH-),选项B正确;
C、H2A的第二步电离常数为K=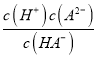 =c(H+)=10-7.2mol·L-1,数量级为10-8,选项C正确;
=c(H+)=10-7.2mol·L-1,数量级为10-8,选项C正确;
D、当吸收液呈中性时,根据电荷守恒:c(H+)+c(Na+)=c(HA-)+2c(A2-)+c(OH-),c(H+)=c(OH-),即:c(Na+)= c(HA-)+2c(A2-),选项D正确;
答案选A。

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目