题目内容
11.下列说法中正确的是( )| A. | 摩尔既是物质的数量单位又是物质的质量单位 | |
| B. | 常温常压下,48gO2所占的体积是33.6L | |
| C. | 阿伏加德罗常数的数值就是0.012kg12C中含有的碳原子数目 | |
| D. | 把1molNaCl溶于1L水中,所得溶液物质的量浓度为1mol/L |
分析 A.摩尔是物质的量的单位;
B.常温常压下,气体的Vm>22.4L/mol;
C.1mol任何粒子的粒子数叫做阿伏伽德罗常数;
D.把1molNaCl溶于1L水中,溶液体积大于1L.
解答 解:A.摩尔是物质的量的单位,不是物质的数量、质量的单位,故A错误;
B.常温常压下,气体的Vm>22.4L/mol,48gO2所占的体积大于33.6L,故B错误;
C.1mol任何粒子的粒子数叫做阿伏伽德罗常数,1mol任何粒子的粒子数与0.012kg 12C中含有的碳原子数目相同,故C正确;
D.溶液的体积不等于溶剂的体积,把1molNaCl溶于1L水中,溶液体积大于1L,故D错误.
故选C.
点评 本题综合考查了物质的量及其单位、气体摩尔体积,为高频考点,侧重于双基的考查,题目难度不大,注意气体摩尔体积的适用条件.

练习册系列答案
相关题目
1.下列各组离子在满足指定条件下,能大量共存的是( )
| A. | 无色溶液:Cu2+、K+、Cl-、CO${\;}_{3}^{2-}$ | |
| B. | 使酚酞显红色的溶液:Mg2+、Fe2+、Cl-、SO${\;}_{4}^{2-}$ | |
| C. | 加Fe粉能产生H2的溶液:Ba2+、Na+、Cl-、SO${\;}_{4}^{2-}$ | |
| D. | 加盐酸能产生气体的溶液:Na+、K+、NO${\;}_{3}^{-}$、HCO${\;}_{3}^{-}$ |
2.下列有关说法中错误的是( )
| A. | 某燃料电池用熔融碳酸盐作电解质,两极分别通入CO和O2,则通入CO的一极为负极,电极反应式为CO-2e-+CO32-=2CO2 | |
| B. | Zn粒与稀硫酸反应制氢气时,为加快反应速率,可在反应过程中滴加几滴CuSO4溶液 | |
| C. | 根据自发氧化还原反应Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O设计原电池,可在常温下用铜和铁作电极,使用浓硝酸作电解质溶液 | |
| D. | 原电池中电子从负极出发,经外电路流向正极,再从正极经电解液回到负极构成闭合回路 |
19.关于容量瓶的使用,下列操作正确的是( )
| A. | 使用前要无需检验容量瓶是否漏液 | |
| B. | 用蒸馏水洗涤后必须要将容量瓶烘干 | |
| C. | 为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行 | |
| D. | 为了使所配溶液浓度均匀,定容结束后,要摇匀 |
6.下列各组中的离子,在溶液中能大量共存的是( )
| A. | Ag+、H+、Cl-、CO32- | B. | H+、Ba2+、OH-、SO42- | ||
| C. | Ba2+、K+、Cl-、NO3- | D. | Ca2+、HCO3-、Cl-、OH- |
16.有关物质分类和胶体的叙述.下列有关物质的分类说法正确的是( )
| A. | 金属氧化物一定是碱性氧化物 | |
| B. | 胶体和其他分散系的本质区别是分散质粒子大小不同 | |
| C. | 生石灰、醋酸、纯碱、氯化钠对应的物质类别是氧化物、酸、碱、盐 | |
| D. | 酸性氧化物一定是非金属氧化物 |
3.下列离子方程式中,正确的是( )
| A. | 碳酸氢钠与硫酸氢钠反应:HCO3-+HSO4-═SO42-+H2O+CO2↑ | |
| B. | 硫酸与氢氧化钡反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 锌和稀硫酸反应:Zn+2H+═Zn2++H2↑ | |
| D. | 氧化铜和盐酸反应:O2-+2H+═H2O |
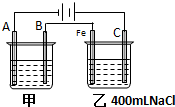 如图为相互串联的甲、乙两电解池试回答:
如图为相互串联的甲、乙两电解池试回答: 加入0.2mol的MnO2粉末于100mL过氧化氢的溶液中(密度为1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题:
加入0.2mol的MnO2粉末于100mL过氧化氢的溶液中(密度为1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题: